Đang tải...

Đang tải...
Nước trên Trái Đất
Trái Đất đôi khi được gọi là "Hành tinh Xanh" do lượng nước lớn có mặt trên bề mặt của nó. Đại dương và biển phủ hơn 70% bề mặt trái đất.
Dưới đây là bảng đánh giá thể tích nước trên Trái Đất:
|
Dự trữ nước |
Thể tích (km3) |
Thể tích (%) |
|
Đại dương và biển |
1,320,000,000 |
97.2 |
|
Băng (sông, băng) |
25,000,000 |
1.8 |
|
Nước ngầm |
13,000,000 |
0.9 |
|
Nước bề mặt |
250,000 |
0.02 |
|
Khí quyển (mây, mưa) |
13,000 |
0.001 |
Phân tử nước
Nước là một phân tử đơn giản gồm 2 nguyên tử hydro kết hợp với 1 nguyên tử oxy, cho phép xuất hiện những đặc tính đặc biệt khiến nước trở thành dung môi quan trọng nhất trên trái đất và là hỗ trợ thiết yếu cho sự phát triển của sự sống. Nguyên tử oxy của phân tử nước có độ âm điện lớn hơn nguyên tử hydro (độ âm điện là khả năng thu hút electron của nguyên tử của 1 nguyên tố). Kết quả là trong phân tử nước phía chứa nguyên tử oxy mang điện tích âm và phía còn lại mang điện tích dương, do đó hình thành sự lưỡng cực của phân tử.
Momen lưỡng cực của phân tử nước được thể hiện trong hình bên dưới:

Hình 1: Sự lưỡng cực của phân tử nước
Momen lưỡng cực này làm cho các phân tử nước bị hút vào nhau (phía hydro dương bị hút về phía oxy âm) và các phân tử phân cực khác. Lực hút này được gọi là liên kết hydro và giải thích một số tính chất của nước.
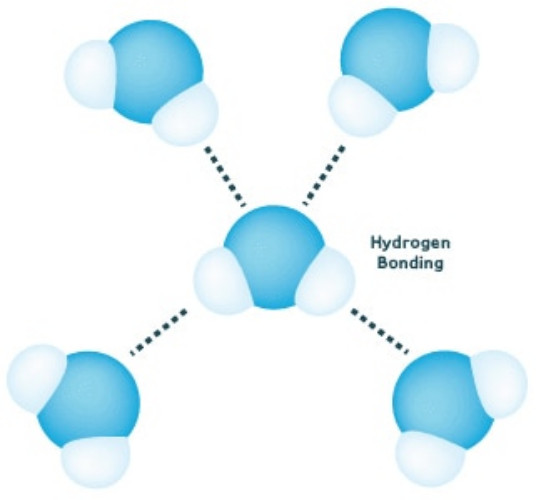
Hình 2: Liên kết hydro
Sự lưỡng cực phân tử nước và sự hình thành liên kết hydro giải thích một số tính chất của nước như nhiệt độ nóng chảy và điểm sôi cao của nước do cần năng lượng để phá vỡ liên kết hydro, băng có khối lượng riêng thấp hơn nước lỏng, sức căng bề mặt cao, nhiệt bay hơi và độ nhớt của nước, và ở một mức độ nào đó khả năng hòa tan nhiều chất của nước.
Nước là một dung môi tuyệt vời cho muối vì chúng được tạo thành từ các ion tích điện âm và dương, và do đó các ion từ muối sẽ được bao quanh bởi các phân tử nước lưỡng cực. Nước còn là dung môi tốt cho các phân tử hữu cơ trung tính và hình thành liên kết hydro với nhiều phân tử tham gia vào quá trình sống như glucose, protein, axit nucleic….

Hình 3: Muối hòa tan bởi các phân tử nước
Vì nước là dung môi tuyệt vời nên nước siêu tinh khiết rất dễ bị nhiễm bẩn.
Nước siêu tinh khiết có điện trở suất 18,2 MΩ·cm ở 25°C được cho vào cốc thủy tinh và theo dõi sự biến đổi điện trở suất theo thời gian. Các kết quả được thể hiện ở Hình 4, sự nhiễm bẩn nhanh chóng của nước bởi CO2 từ không khí, dẫn đến việc tạo ra HCO3- trong nước và dẫn đến điện trở suất giảm từ 18,2 MΩ·cm ở 25°C xuống 4 MΩ·cm ở 25°C trong khoảng một giờ.

Hình 4: Theo dõi sự nhiễm bẩn của nước siêu tinh khiết theo thời gian
Hiện tưởng xảy ra với CO2 cũng dễ dàng xảy với các chất hóa học khác có thể có trong không khí của phòng thí nghiệm như khói axit (từ axit nitric hoặc axit chlorhydric) và các dung môi dễ bay hơi (chẳng hạn như toluene, axeton hoặc tetrahydrofuran).
Nước siêu tinh khiết cũng dễ bị ô nhiễm bởi các vật liệu như natri và silica từ các chai lọ đựng bằng thủy tinh, các este phthalate từ ống PVC, florua từ ống PTFE, và các ion kim loại từ hộp đựng bằng kim loại.
Đây là lý do tại sao, để giảm thiểu nguy cơ nhiễm bẩn cũng như sự ảnh hưởng tới kết quả thí nghiệm có thể do các chất bẩn gây ra, nước siêu tinh khiết phải được sản xuất ngay trước khi sử dụng và sử dụng ngay lập tức để rửa lần cuối cho các dụng cụ thủy tinh hoặc cho việc chuẩn bị dung dịch.
Tính chất lý hóa của nước
Nhiều thông số lý hóa, nước có giá trị vượt trội; nhiều giá trị này có thể được giải thích do sự hình thành các liên kết hydro của các phân tử nước với nhau.
Một số thông số chính của nước có độ tinh khiết cao được liệt kê dưới đây:
|
Điểm sôi |
100 |
°C |
tại áp suất 1 kg/cm2 |
|
Độ dẫn nhiệt |
0,055 |
µS/cm |
ở 25°C |
|
Điểm tới hạn |
374 |
°C |
|
|
Khối lượng riêng (băng) |
920 |
g/L |
|
|
Khối lượng riêng (chất lỏng) |
997,07 |
g/L |
ở 25°C |
|
Khối lượng riêng (chất lỏng) |
999,97 |
g/L |
ở 4°C |
|
Khối lượng riêng ộ (chất lỏng) |
999,83 |
g/L |
ở 0°C |
|
Hằng số điện môi |
78,4 |
|
ở 25°C |
|
Hằng số Ebullioscopic |
0,51 |
K kg/mol |
|
|
Entropy của sự hóa hơi |
109 |
JK -1mol-1 |
|
|
Nhiệt phản ứng tổng hợp |
5,98 |
kJ-1 |
|
|
Nhiệt hóa hơi |
40,7 |
kJ-1 |
|
|
Độ nóng chảy |
0 |
°C |
|
|
Nồng độ mol |
55.346 |
mol/L |
|
|
Khối lượng phân tử |
18.0153 |
g/mol |
|
|
Trọng lượng phân tử |
18.0153 |
Dalton |
|
|
pH |
7 |
pH |
ở 25°C |
|
Điện trở suất |
18.2 |
MO·cm |
ở 25°C |
|
Sức căng bề mặt |
72,75 |
mJ/m2 |
|
|
Sức căng bề mặt |
72,75 |
mJ/m2 |
ở 20°C |
|
Độ dẫn nhiệt |
0,58 |
JK -1 m-1 s-1 |
|
|
Gấp ba lần Điểm |
0,01 |
°C |
tại 611,73 Pa |
|
Độ nhớt |
0,89 |
cP |
ở 25°C |
Sự phân ly nước & pH
Phân tử nước có một đặc tính thú vị khác là khả năng tự phân ly. Điều này được thể hiện trong phương trình dưới đây:

Với Kw là hằng số cân bằng của phản ứng cân bằng phân ly nước. Do định luật tác dụng khối lượng: [H+][OH-] = Kw [H2O]
Vì nồng độ của nước là một hằng số đối với một nhiệt độ nhất định là một hằng số, phương trình có thể được đơn giản hóa như sau: [ H+][ OH-] = K
Với K là hằng số ion hóa của nước, tính bằng (mol/L)². Giá trị của K thay đổi theo nhiệt độ.
|
Nhiệt độ (°C) |
K (mol/L)2 |
|
18 |
0.77 10-14 |
|
25 |
10 -14 |
|
50 |
5.5 10-14 |
Điều này có nghĩa là ở nhiệt độ tham chiếu 25°C, ở trạng thái cân bằng, [H+] = [OH-] = 10-7 mol/L.
Giá trị pH là logarit cơ số 10 của nồng độ proton: pH = - log[H+]
Và do đó, giá trị pH đối với nước tinh khiết được tính như sau: pH = - log[10-7] = 7,0
Tuy nhiên khi đo giá trị pH của nước tinh khiết, các máy đo pH thông thường sẽ không cho ra giá trị này. Do các máy đo pH thông thường trong phòng thí nghiệm chưa được thiết kế để đo pH của nước siêu tinh khiết chứa rất ít ion, nên kết quả thu được là sự kết hợp giữa ảnh hưởng của việc nước siêu tinh khiết bị nhiễm bẩn nhanh chóng bởi CO2 từ không khí và ảnh hưởng do thiết bị đo tạo ra.
Thực tế là pH của nước siêu tinh khiết có điện trở suất bằng 18,2 MΩ·cm tại 25°C là ~7,0 (6,998), đã được chứng minh trong nghiên cứu đăng trên American Laboratory News tháng 6/tháng 7 năm 2006: High-Purity Water and pH by Estelle Riché, Aude Carrié, Nicolas Andin and Stéphane Mabic. Trong đó, các tác giả đã chứng minh pH của nước siêu tinh khiết có điện trở suất bằng 18,18 MΩ·cm ở 25°C bằng 6,998 (~ 7,0). Việc thay đổi giá trị pH đó, ví dụ như thêm một axit mạnh như HCl hoặc một bazơ mạnh như NaOH, cũng sẽ dẫn đến việc giảm điện trở suất vì khi đó nhiều ion thêm đã được bổ sung được đưa vào nước. .
Do đó, giá trị điện trở suất bằng 18,18 MΩ·cm tại 25°C sẽ đồng nghĩa với giá trị pH bằng 6,998 ở 25°C là giá trị pH của nước siêu tinh khiết.