
Đang tải...

Đang tải...
Mở rộng khả năng sàng lọc các chất hướng thần mới trong phòng thí nghiệm độc học và pháp y sử dụng kĩ thuật SWATH DIA và QTOF
Keywords: QTOF, Time of Flight, LC/MS, LC/HRMS, novel pyschoactive subtances, suspect screening, non-targeted screening, biological samples, urine, whole blood, SWATH DIA, khối phổ thời gian bay, sắc ký lỏng khối phổ, sàng lọc, không mục tiêu
Giới thiệu: Bài viết này có sử dụng nhiều nội dung trong ghi chú ứng dụng “Expanding NPS screening capabilities in the forensic toxicology laboratory Screen for over 900 compounds using the vMethod application on the SCIEX X500R QTOF system”. Thêm vào đó cung cấp cho bạn đọc một số khái niệm cơ bản liên quan tới khối phổ thời gian bay (Time of Flight), và trình bày quan điểm của tác giả liên quan tới việc sàng lọc và định danh tin cậy các chất liên quan trong nền mẫu sinh học gồm mẫu máu và mẫu nước tiểu. Về tác giả, TS. Lê Sĩ Hưng, tốt nghiệp tiến sĩ tại đại học BOKU Vienna (Cộng hoà Áo) ngành hoá phân tích, đã có trên 10 năm kinh nghiệm làm việc với các thiết bị khối phổ, tập trung vào ứng dụng các kỹ thuật khối phổ trong phân tích các chất chuyển hoá và protein trong các đối tượng mẫu sinh học, ORCID: 0000-0002-0762-3492
Mở đầu
Hiện nay sự xuất hiện và gia tăng số lượng các chất hướng thần mới (Novel pyshoactive subtances – NPS) trên thị trường toàn cầu tiếp tục gây nhiều thách thức về sức khỏe và an toàn. NPS là nhóm chất độc được thiết kế để mô phỏng hiệu ứng của các loại ma túy nằm trong danh mục kiểm soát. Các NPS này thường được phân vào 4 nhóm chính: các chất gây ảo giác tổng hợp, các cannabinoid tổng hợp, các chất kích thích tổng hợp và các chất chống trầm cảm tổng hợp (bao gồm các opioid tổng hợp và benzodiazepine). Việc phân loại đơn giản này không thể hiện được sự đa dạng về tính chất hóa học, sự chuyển hóa, độc tính và độ mạnh, cũng như không nhấn mạnh tới mức độ nguy hiểm và sự phức tạp từ hiệu ứng kết hợp do các chất này gây ra. Hơn hết, tần suất xuất hiện của các NPS mới trên thị trường, sự thiếu thông tin về thành phần, độ tinh khiết và hiệu ứng thuốc, kết hợp với sự hạn chế của các chất chuẩn tham chiếu làm cho việc sàng lọc, phát hiện và giám sát các chất này trở nên vô cùng khó khăn, đặt ra yêu cầu cấp thiết cần có phương pháp sàng lọc kịp thời để phát hiện và xác định chính xác các NPS mới xuất hiện trên thị trường
Nguyên lý hoạt động cơ bản của hệ thống LC-QTOF bao gồm: 1, mẫu sau khi xử lý được bơm lên cột tách của hệ thống sắc ký lỏng hiệu năng cao (HPLC); 2, các chất phân tích sẽ trải qua các tương tác qua lại giữa pha động và pha tĩnh và tách ra khỏi nhau, trước khi tiến vào hệ thống khối phổ; 3, nguồn ion hoá (ionization source) của hệ thống khối phổ sẽ chuyển các chất phân tích từ pha lỏng sang pha khí và tiến hành quá trình ion hoá trước khi các ion chất phân tích tiến vào khu vực chân không bên trong máy; 4, các ion được thu giữ, tái tập trung và di chuyển bên trong thiết bị hoặc phân mảnh ở Q2 bằng các hệ thống dẫn, quang học ion (ion guide, ion optics), sau đó được nén thành các gói ion bằng các xung điện kéo/đẩy trong khu vực ở phía trước ống bay (extraction region); 5, các gói ion này được cung cấp cùng 1 động năng để tiến vào ống bay (flight tube) nơi chúng sẽ được phân tách dựa trên khối lượng (các ion có cùng khối lượng có cùng thời gian bay, ion nhẹ hơn thì bay nhanh hơn ion nặng); 6, các ion tách ra khỏi nhau, lần lượt chạm tới detector và được ghi nhận tín hiệu (thời gian bay và cường độ tín hiệu). Các thiết bị QTOF cho phép thu thập thông tin về số khối chính xác của tất cả các ion mẹ có thể có trong mẫu qua các “MS survey scan”, và thông tin về các ion phân mảnh (ion con) tương ứng và đặc trưng của từng chất qua các “MS/MS scan”, từ đó cung cấp khả năng định danh, xác nhận và đối chiếu với thư viện các chất đã biết hoặc mới xuất hiện.
Ưu điểm của vMethod cho việc sàng lọc và định danh các NPS
“vMethod” là một phương pháp phân tích toàn diện được cung cấp bởi Sciex tập trung cho mục đích sàng lọc độc học pháp y trên các hệ thống khối phổ phân giải cao tứ cực thời gian bay (QTOF) của hãng (e.g., X500R, Zeno TOF). Thiết bị khối phổ phân giải cao (High Resolution Mass Spectrometry – HRMS) có thể được hiểu là các thiết bị khối phổ có độ phân giải khối cao (high mass resolving power, Rs  ~40000), trong đó Rs là khả năng thiết bị có thể phân giải được 2 số khối liền kề nhau, thường được thể hiên bằng công thức m/dm (trong đó, m là giá trị m/z của 1 ion, và dm là độ rộng của píc khối phổ của ion đó tính ở một nửa chiều cao hoặc tại 10% chiều cao của píc). Khối phổ phân giải cao cũng có thể được hiểu là khả năng thiết bị có thể đo được số khối chính xác của 1 chất phân tích với độ chính xác khối (mass accuracy) cao (ví dụ: mass accuracy
~40000), trong đó Rs là khả năng thiết bị có thể phân giải được 2 số khối liền kề nhau, thường được thể hiên bằng công thức m/dm (trong đó, m là giá trị m/z của 1 ion, và dm là độ rộng của píc khối phổ của ion đó tính ở một nửa chiều cao hoặc tại 10% chiều cao của píc). Khối phổ phân giải cao cũng có thể được hiểu là khả năng thiết bị có thể đo được số khối chính xác của 1 chất phân tích với độ chính xác khối (mass accuracy) cao (ví dụ: mass accuracy  5 ppm). vMethod cung cấp một quy trình toàn diện, bao gồm quy trình chuẩn bị mẫu và phương pháp LC-MS/MS, để phân tích các hợp chất liên quan trong nền mẫu sinh học trong một lần đo duy nhất
5 ppm). vMethod cung cấp một quy trình toàn diện, bao gồm quy trình chuẩn bị mẫu và phương pháp LC-MS/MS, để phân tích các hợp chất liên quan trong nền mẫu sinh học trong một lần đo duy nhất

Hình 1. vMethod kết hợp với X500R QTOF cung cấp giải pháp tổng thể cho việc sàng lọc các thuốc cấm bao gồm quy trình xử lý mẫu máu toàn phần và nước tiểu của người, điều kiện chạy LC, phương pháp MS/MS, và quy trình xử lý số liệu ổn định nhằm đem lại kết quả ngắn gọn và tin cậy.
vMethod đã được mở rộng để phân tích thêm 130 NPS phổ biến và mới xuất hiện gần đây trên thị trường chất cấm. Thông tin phân tích của 130 NPS này bao gồm thời gian lưu của chất, khoảng tuyến tính, độ chụm trong ngày và giữa các ngày của phương pháp được đánh giá trên nền mẫu nước tiểu và mẫu máu toàn phần của người. Ngoài ra, thông tin cấu trúc chi tiết của các NPS này dưới dạng phổ TOF MS/MS chất lượng cao (nhiều phân mảnh, phân giải cao, tín hiệu tốt) được thu thập bằng cách phân tích các chất chuẩn và đối chiếu với thư viện phổ để xác nhận danh tính các chất có liên quan về mặt cấu trúc, bao gồm các đồng phân liên quan. Quy trình mới này cho phép tăng cường khả năng sàng lọc các NPS trên hệ thống QTOF X500R và có thể được áp dụng cho cả các phân tích có mục tiêu (targeted analysis – là phép phân tích nhắm tới các đối tượng đối tượng phân tích cụ thể và xác định, ví dụ: định lượng các hexose sugar phosphate trong dịch men Pichia Pastoris) và không mục tiêu (non-targeted analysis – là phép phân tích không có đối tượng phân tích xác định, nhằm thu được nhiều thông tin nhất trong mẫu mà không gây ra sự thiên vị (unbiased analysis) và đưa ra các giả thiết sinh học). Quy trình này cũng có thể được áp dụng dễ dàng lên các tập dữ liệu MS và MS/MS cũ (retrospective analyses) cho việc phát hiện các NPS mới mà không cần phải đo lại mẫu.
- vMethod bao gồm thông tin về 130 NPS, công thức phân tử, số khối chính xác của mảnh mẹ và thời gian lưu của các chất này.
- vMethod có thể được tải xuống và nạp trực tiếp vào phần mềm Sciex OS để thiết lập phương pháp phân tích và phương pháp xử lý dữ liệu cho cả các phân tích định danh NPS có mục tiêu và không có mục tiêu trong các mẫu thật.
- Cho phép tái xử lý các tập dữ liệu cũ để sàng lọc và phát hiện NPS mà không cần đo lại mẫu.
- Quy trình hiện tại cho phép cho người dùng hệ thống QTOF X500R nâng tổng số lượng hợp chất tối đa có thể được sàng lọc trong một lần đo duy nhất lên tới hơn 900 chất.
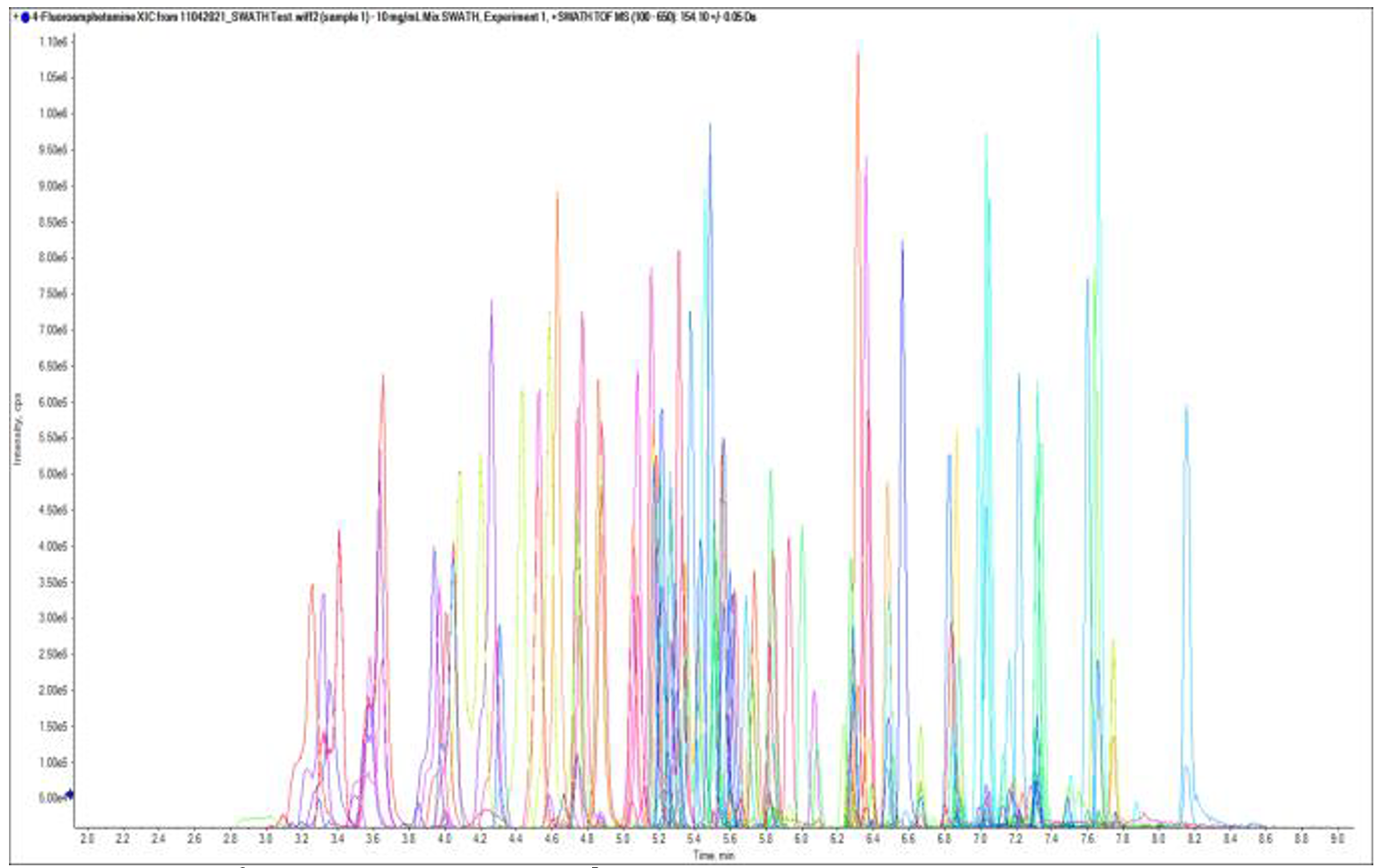
Hình 2. Phổ XIC của 900 chất liên quan trong vMethod được phân tích trong cùng 1 lần đo sử dụng hệ sắc kí lỏng khối phổ phân giải cao tứ cực thời gian bay – Sciex QTOF X500R
Phương pháp phân tích
130 NPS bao gồm 22 chất kích thích, 35 benzodiazepines, các chất gây ảo giác phân ly và các chất gây ảo giác khác, 34 opioids tổng hợp và 28 cannabinoids tổng hợp được chọn lọc dựa trên xu hướng và thông tin giám sát về NPS trên thế giới. Các chất chuẩn tham chiếu và chất nội chuẩn được mua từ Cerilliant (Round Rock, TX) và Cayman (Ann Arbor, MI). Mẫu chuẩn hỗn hợp (130-STDmix) gồm 130 chất chuẩn NPS nồng độ 1 µg.mL-1 được chuẩn bị trong nước. Hỗn hợp chất chuẩn nồng độ 10 ng.mL-1 được chuẩn bị trong nước cùng với hỗn hợp 10 chất nội chuẩn phù hợp. Mẫu 130-STDmix được dùng để xác định thời gian lưu của 130 NPS mục tiêu và xây dụng thư viện phổ TOF MS/MS tùy chỉnh với chất lượng cao.
Chuẩn bị đường chuẩn:
- Thêm 10 uL hỗn hợp chuẩn 1 µg.mL-1 vào 90 µL mẫu nước tiểu hoặc mẫu máu toàn phần. Các mẫu thêm chuẩn spiked_Cal này được dùng để chuẩn bị 2 nhóm mẫu, mỗi nhóm gồm 6 điểm chuẩn với nồng độ từ 0,1 – 100 ng.mL-1.
- Với mẫu máu toàn phần: 10 µL của hỗn hợp nội chuẩn (10 ng.mL-1) được thêm vào 90 µL của các mẫu thêm chuẩn spiked_Cal. 900 µL dung dịch MeOH/ACN:50/50 (v/v) được thêm vào để kết tủa, loại protein. Mẫu được lắc trong 1 phút và siêu âm trong 3 phút, rồi tiếp tục lắc trong 1 phút và ly tâm trong 5 phút ở tốc độ 8000 vòng/phút. Phần dung dịch phía trên được chuyển sang ống Eppendorf sạch và làm khô hoàn toàn bằng khí nitơ, sau đó thêm vào 500 µL dung dịch MeOH/H2O:20/80 (v/v). Mẫu được lắc đều trong 30 giây, sau đó ly tâm trong 5 phút ở tốc độ 8000 vòng/phút. Phần dung dịch phía trên được chuyển sang một lọ thủy tinh tối màu để phân tích. Quy trình kết tủa protein cho mẫu máu toàn phần của người được tóm tắt trong hình 3 (Hình 3).

Hình 3. Tóm tắt quy trình kết tủa protein xử lý mẫu máu màu toàn phần của người
- Với mẫu nước tiểu: 10 µL hỗn hợp nội chuẩn (10 ng.mL-1) được thêm vào 90 µL của các mẫu thêm chuẩn spiked_Cal. 700 µL H2O và 200 µL MeOH được thêm vào mẫu, mẫu được lắc trong 30 giây và ly tâm trong 5 phút ở tốc độ 8000 vòng/phút. Phần dung dịch phía trên được chuyển sang một lọ thủy tinh tối màu để phân tích. Quy trình chuẩn bị “dilute-and-shoot” (pha loãng & đo) cho mẫu nước tiểu của người được tóm tắt trong hình 4 (Hình 4).

Hình 4. Quy trình “dilute-and-shoot” xử lý mẫu nước tiểu của người
HPLC:
- Cột Phenomenex Kinetex Phenyl-Hexyl (50 × 4,6 mm, 2,6 µm, 00B-4495-E0) trên hệ thống ExionLC AC sử dụng các điều kiện mặc định của vMethod. Pha động được sử dụng là ammonium formate (AmFA) pha trong nước và MeOH với các nồng độ muối thích hợp. Tốc độ dòng là 0,7 mL/phút. Thể tích mẫu bơm lên cột là 10 µL, tổng thời gian chạy LC là 9,5 phút.
- Tối ưu điều kiện tách LC cho các NPS là đồng phân: Hỗn hợp chuẩn gồm 130 NPS nồng độ 10 ng.mL-1 được sử dụng để xác định thời gian lưu của các chất phân tích. Sắc ký đồ của 130 NPS được thể hiện trong hình 1 (Hình 1). Hầu hết 130 NPS đều có thể được tách tương đối tốt sử dụng phương pháp mặc định của vMethod với gradient 9,5 phút, trừ một vài đồng phân.
MS:
Hai kỹ thuật ghi dữ liệu không mục tiêu được sử dụng và so sánh, gồm kỹ thuật ghi phổ MS/MS dựa trên thông tin cho trước (Data Dependent Acquisition - DDA) và ghi phổ MS/MS tự động theo từng khoảng khối liên tục (cửa sổ khối) không phụ thuộc vào thông tin cho trước (SWATH Data Independence Acquistion). Cả DDA và SWATH DIA đều bắt đầu với việc ghi phổ TOF MS trên toàn dài khối (MS survery scan) để thu thập thông tin về số khối chính xác cùng cường độ tín hiệu của các các ion mẹ từ 100 – 650 Da.
- Với DDA, phổ MS/MS phân giải cao được ghi lại trên toàn dải từ 25 – 650 Da, và tối đa 14 ion mẹ được tự động chọn ở Q1 dựa trên cường độ tín hiệu để phá mảnh ở Q2 và ghi phổ MS/MS. Các ion mẹ được chọn phải có tín hiệu thu được từ MS survey scan cao hơn 1 ngưỡng nhất định, và được sắp xếp theo thứ tự ưu tiên dựa trên cường độ của tín hiệu (i.e., ion mẹ có tín hiệu càng cao càng được ưu tiên, trừ 1 số trường hợp ngoại lệ)
- Với SWATH DIA, 14 cửa sổ khối chia đều trên toàn dải 100 – 650 Da được lựa chọn ở Q1 (i.e., 25 – 65 Da, 64 – 104 Da, 103 – 143 Da, …, 610 – 650 Da), toàn bộ ion mẹ trong từng cửa sổ khối được phá mảnh cùng lúc tại Q2, và ghi lại phổ MS/MS phân giải cao từ 25 – 650 Da.
Cả 2 kỹ thuật ghi tín hiệu này đều cho phép thu được phổ MS/MS phân giải cao toàn diện với chất lượng cao, từ đó cho phép phân tích các phân mảnh của chất một cách đáng tin cậy, giúp việc đối chiếu kết quả đo được với cơ sở dữ liệu thư viện phổ để định danh các chất. Việc ghi dữ liệu được thực hiện bằng phần mềm SCIEX OS, phiên bản 2.0. Các mẫu được bơm lặp ba lần trong 3 ngày liên tiếp để xây dựng và đánh giá phương pháp xử lý dữ liệu.
Xử lý dữ liệu và định danh chất tin cậy:
Để định danh chất 1 cách tin cậy, Schymanski et al. đề xuất 5 cấp độ định danh với độ tin cậy tăng dần, đề xuất này đã được đánh giá và chấp nhận như một guideline bởi nhiều nhóm nghiên cứu khác nhau trên thế giới (Hình 5A). Năm cấp độ dịnh danh này bao gồm: Mức 5, độ tin cậy thấp nhất – có số khối chính xác; Mức 4, có công thức phân tử rõ ràng – là khả năng gán được công thức phân tử cho số khối đó; Mức 3, tồn tại cấu trúc có thể có – có các bằng chứng ủng hộ sự tồn tại của các cấu trúc, nhưng không đủ để kết luận được cấu trúc chính xác (ví dụ như trong trường hợp các đồng phân vị trí); Mức 2, có cấu trúc trong thư viện tham chiếu hoặc được xác định bằng các phương pháp khác; Mức 1, độ tin cậy cao nhất – có xác nhận lại với chất chuẩn
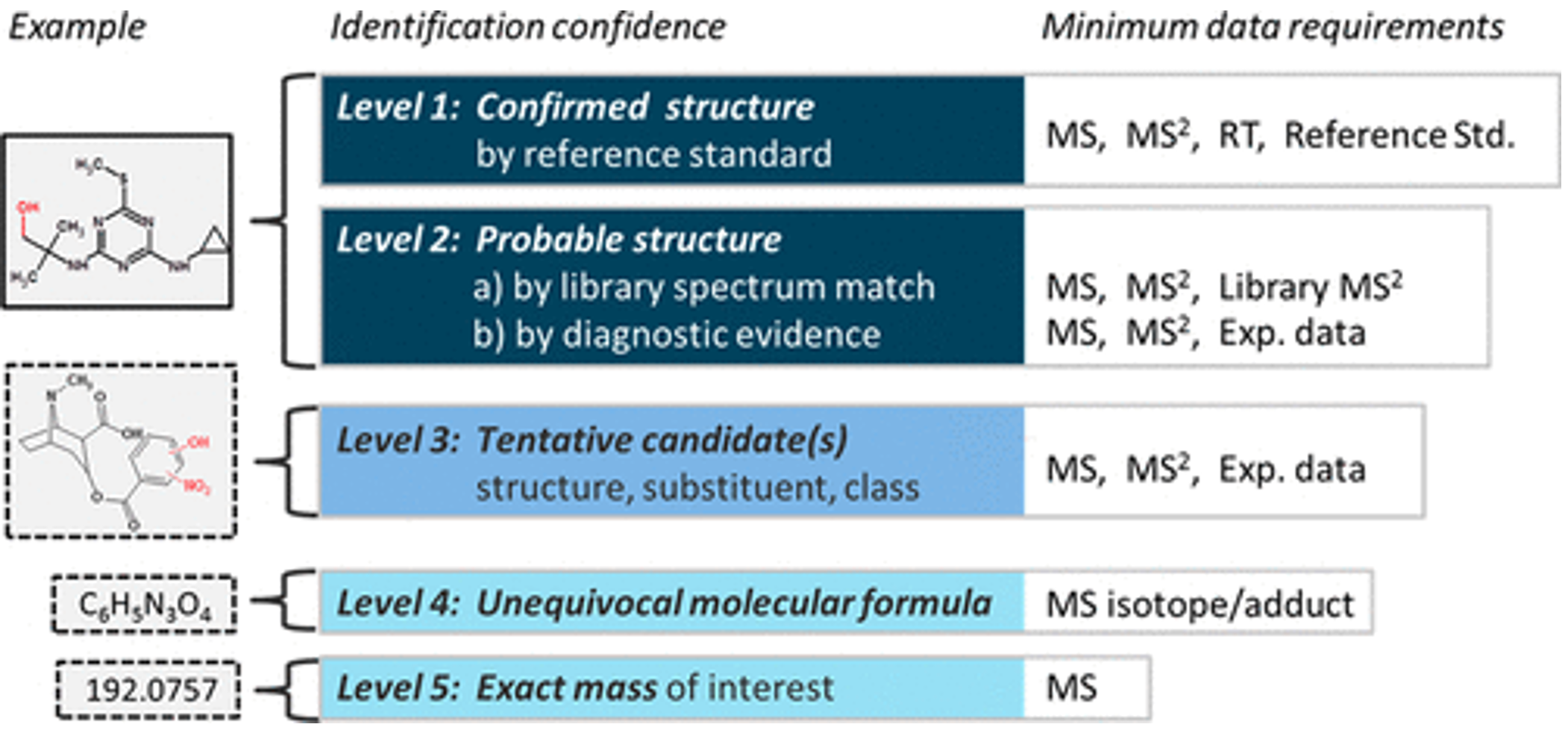
Hình 5A. Năm cấp độ tin cậy trong việc định danh chất

Hình 5B. Bốn tiêu chí để đảm bảo độ tin cậy được thiết lập trong vMethod cho việc định danh tin cậy 130 NPS liên quan.
Dựa trên các cấp độ tin cậy đề xuất của Schymanski et al. các thiết bị khối phổ có độ phân giải khối cao là một trong những yêu cầu quan trọng đầu tiên cho việc định danh tin cậy chất. Việc đo được số khối chính xác (accurate mass) của 1 chất với sai số thấp (i.e., <5 ppm), là thông tin quan trọng đầu tiên cho phép các thuật toán đề xuất các công thức phân tử có thể của chất (số lượng các công thức phân tử đề xuất có thể lên tới từ vài trăm tới vài ngàn công thức tuỳ từng điều kiện cụ thể). Tuy nhiên kể cả với các thiết bị có độ phân giải khối rất cao (e.g., orbitrap, FT-ICR – Rs > ~80000) cho phép thu được số khối chính xác với độ chính xác khối < 1 ppm, thì việc chỉ dựa vào thông tin này là không đủ để có thể loại bỏ được tất cả các công thức phân tử không phù hợp, nhất là cho các phân tử lớn (phân tử có khối lượng lớn) hoặc các phân tử có thành phần nguyên tố phức tạp  0,1 ppm.
0,1 ppm.
Việc xử lý dữ liệu được thực hiện bằng phần mềm Sciex OS phiên bản 2.0, để định danh các chất phân tích có thể có trong mẫu dựa trên các tiêu chí để đảm bảo độ tin cậy, gồm sai số về khối (Mass error, là độ sai lệch giữa số khối đo được với số khối tính theo lý thuyết), thời gian lưu của chất (Retention time), sự khác biệt về tỉ lệ các đồng vị (Isotope ratio difference) và điểm tương đồng khi tham chiếu với thư viện (Library Hit Score) (Hình 5B). Việc tham chiếu cơ sở dữ liệu thư viện phổ được thực hiện bằng cách so sánh phổ MS/MS phân giải cao thu được khi đo các mẫu spiked_Cal với thư viện phổ MS/MS phân giải cao thu được khi ghi tín hiệu của các mẫu 130-STDmix. Việc xử lý dữ liệu phổ thu được được thực hiện tự động bằng thuật toán MQ4. Các giá trị về diện tích píc, đường chuẩn, tính toán nồng độ, độ chụm và độ chính xác của phương pháp được tự động tính và báo cáo bằng SCIEX OS.
Kết quả và thảo luận
Tối ưu hoá gradient cho việc tách các đồng phân
Phổ XIC (Extracted Ion Chromatogram) cho 3 nhóm đồng phân được tách bằng các phương pháp LC với gradient 3,5 phút, 9,5 phút (vMethod) và 15,5 phút được thể hiện trong hình 6 (Hình 6). Hai cannabinoid tổng hợp 5-MDMB-PICA và 5F-EMB-PICA là đồng phân của nhau có cùng thời gian lưu khi sử dụng gradient 3,5 phút, được tách 1 phần với gradient 9,5 phút của vMethod, trong khi với gradient 15,5 phút 2 đồng phân này được tách tương đối tốt khỏi nhau (Hình 6A). Ba đồng phân cathinone tổng hợp gồm eutylone, N-methylone và pentylone, và 2 đồng phân opioid tổng hợp mới gồm isotonitazene và protonitazene có thể được tách tốt chỉ với gradient 3,5 phút (Hình 6B, C). Kết quả thu được chỉ ra rằng các điều kiện tách sắc ký của vMethod đã tương đối phù hợp cho một phương pháp phân tích tổng quát cho phép tách tốt nhiều đồng phân liên quan. Các điều kiện LC như thời gian chạy và gradient có thể được điều chỉnh dễ dàng dựa trên tính chất của các chất phân tích quan tâm.
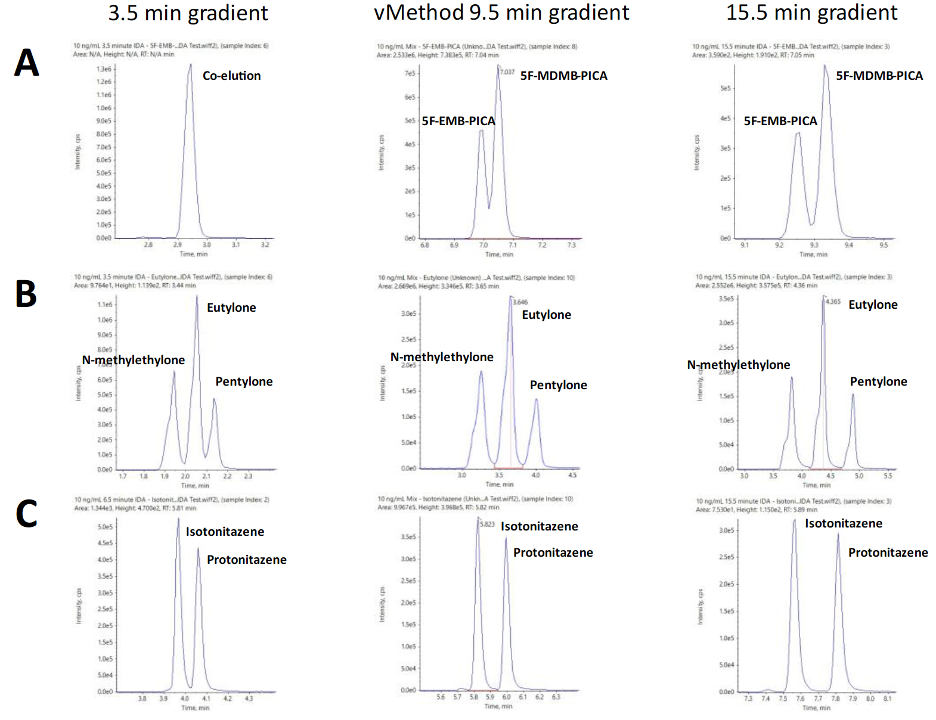
Hình 6. Ảnh hưởng của thời gian chạy gradient lên quá trình tách sắc ký của 3 nhóm đồng phân NPS liên quan.
Các tiêu chí đảm bảo cho việc định danh NPS một cách tin cậy
Mặc dù phép tách sắc ký là yếu tố quan trọng để phân tách và phân biệt các chất phân tích trong một hỗn hợp, thông tin về thời gian lưu thường không đủ để định danh một cách tin cậy các hợp chất có cấu trúc và phổ MS/MS tương tự, ví dụ như các đồng phân hình học và đồng phân đồng khối. Một trong những lợi ích của việc sử dụng khối phổ HRMS kết hợp với kĩ thuật ghi tín hiệu SWATH DIA là cho phép ghi toàn bộ phổ MS và MS/MS phân giải cao cho tất cả các chất có thể hiện diện trong mẫu. Từ số khối chính xác của mảnh mẹ, công thức phân tử tương ứng của chất có thể được đề xuất tự động bởi phần mềm (i.e., Sciex OS). Kết hợp với số khối chính xác của các mảnh con cho phép tiến hành tham chiếu với cơ sở dữ liệu thư viện phổ và từ đó cho phép định danh một cách tin cậy các chất. Các tiêu chí quan trọng bao gồm sai số về số khối, sự khác biệt về tỷ lệ đồng vị, điểm tham chiếu với thư viện và sai số về thời gian lưu thường được sử dụng để định danh chất một cách tin cậy. Hình 5B thể hiện các tiêu chí đánh giá độ tin cậy trong việc định danh các hợp chất được tích hợp trong Sciex OS (Hình 5B). Ngoài các thông số có thể tuỳ chỉnh cho từng tiêu chí, người sử dụng có thể thay đổi trọng số cho điểm kết hợp (Combined Score Weight) của từng tiêu chí tuỳ theo từng ứng dụng và mục đích, qua đó phản ánh độ quan trọng của từng tiêu chí thành phần lên số điểm cuối cùng về độ tin cậy trong việc định danh chất (Combined Score). Trong hình 5B điểm tham chiếu với thư viện có trọng số là 60% có thể hiểu là tiêu chí quan trọng nhất trong 4 tiêu chí được sử dụng, theo sau là sai số về số khối (với trọng số 20%).
Việc xử lý dữ liệu được thực hiện một cách hệ thống bằng Sciex OS để đảm bảo định danh chính xác chất trong khi giảm thiểu tình trạng dương tính/âm tính giả. Khi tiến hành định danh các NPS, Sciex OS cho phép thể hiện các kết quả phân tích một cách trực quan gồm thông tin về phổ XIC, phổ MS và MS/MS, và kết quả tham chiếu thư viện cho từng chất cho phép người sử dụng có thể nhanh chóng kiểm tra các kết quả thu được (Hình 7). Hình 7 thể hiện phổ XIC, phổ MS và MS/MS với điểm tham chiếu thư viện cho 2 opioid tổng hợp 4-Trifluoromethyl-U-47700 và metonitazene. Sai số về thời gian lưu, sai số về số khối, sự khác biệt tỷ lệ đồng vị và điểm tham chiếu với thư viện MS/MS được tự động tính, độ tin cậy của các thông số này được đánh giá và thể hiện một cách trực quan trên phần mềm với tích xanh là độ tin cậy cao, vàng là cần kiểm tra thêm, và đỏ là không đủ tin cậy. Trong ví dụ ở hình 7, sai số về số khối của các chất đều thấp hơn 5 ppm, điểm tham chiếu với thư viện đều lớn hơn 70, thời gian lưu của chất cũng phù hợp với thời gian lưu của chất chuẩn, từ đó thể hiện độ tin cậy cao trong việc định danh của các chất này.
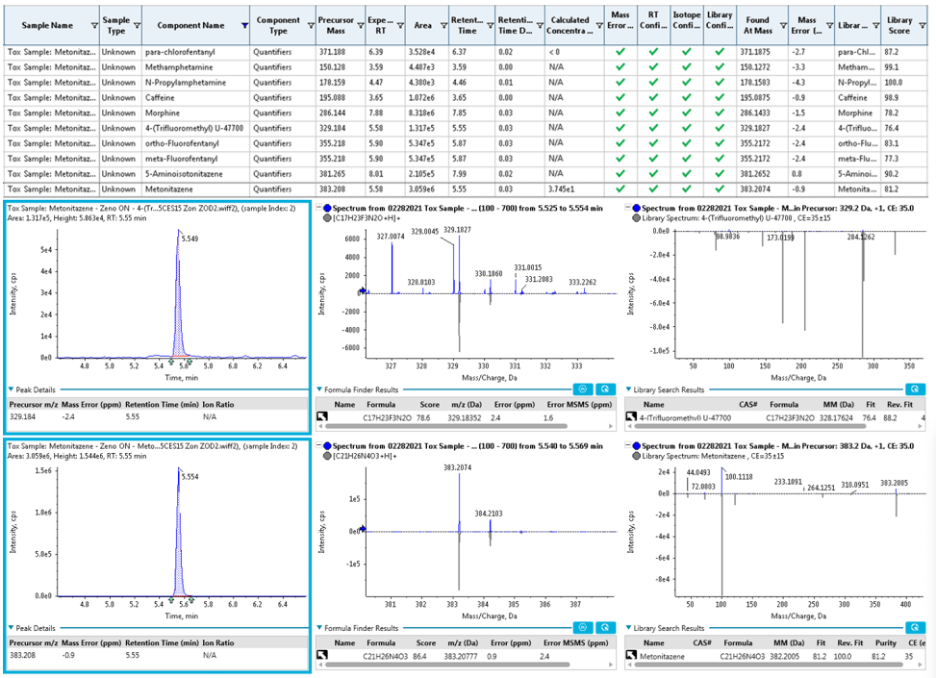
Hình 7. Các kết quả phân tích gồm phổ XIC, phổ MS và MS/MS với điểm tham chiếu thư viện cho 2 opioid tổng hợp 4-Trifluoromethyl-U-47700 và metonitazene.
Hình 8 thể hiện kết quả tái phân tích sử dụng danh sách các NPS mới cập nhật cho một trường hợp tử vong được phân tích lần đầu vào năm 2019 (Hình 8). Kết quả phát hiện dương tính trùng khớp với 6 hợp chất đã được báo cáo vào năm 2019 và phát hiện dương tính thêm với Alpha-PPP, một chất kích thích mới được bổ sung. Giá trị sai số về số khối của ion mẹ < 1 ppm, sai số về thời gian lưu là < 0,5% và điểm tham chiếu với thư viện MS/MS là 98.2% thể hiện độ tin cậy cao trong việc định danh Alpha-PPP.
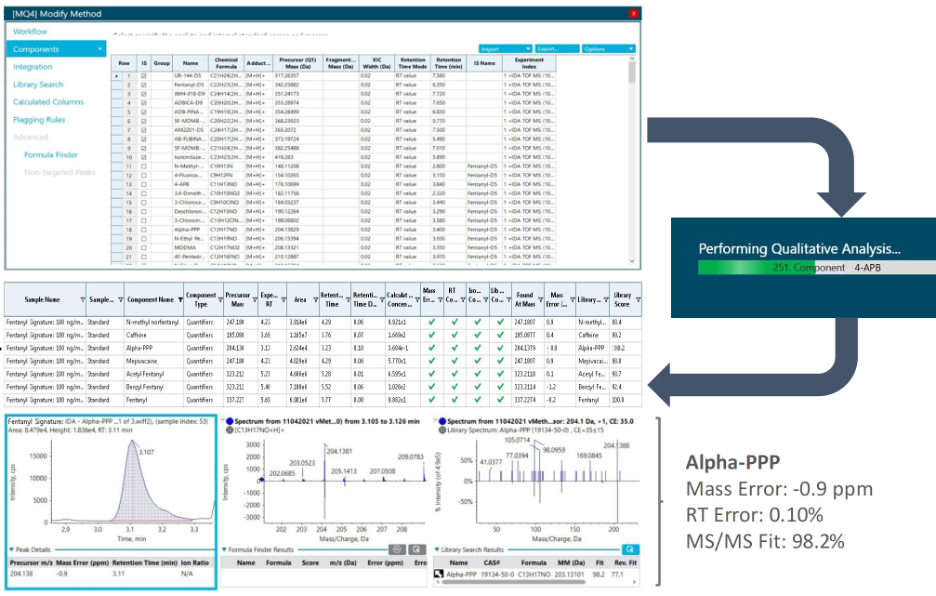
Hình 8. Kết quả tái phân tích sử dụng danh sách các NPS mới cập nhật trong vMethod cho một mẫu cũ được phân tích lần đầu vào năm 2019
Phân tích định lượng linh hoạt các NPS
Ưu điểm của việc sử dụng các kỹ thuật ghi dữ liệu không mục tiêu (i.e., DDA và SWATH DIA) cho việc sàng lọc NPS là việc cung cấp tính linh hoạt trong việc định lượng các chất phân tích. Do cả phổ MS và MS/MS đều được ghi lại, người dùng có thể thực hiện việc định lượng sử dụng thông tin của cả ion mẹ và các ion con. Việc định lượng sử dụng thông tin của ion mẹ là đủ để đạt độ tin cậy yêu cầu, tuy nhiên việc sử dụng thêm thông tin ion con sẽ tăng thêm độ tin cậy đặc biệt là trong trường hợp các mẫu phức tạp. Hình 9 thể hiện các phổ XIC của mẫu trắng và các mẫu có nồng độ từ 0,5 – 100 ng.mL-1 cho việc định lượng 4F-MDMB-BINACA 3,3 dimethylbutanoic sử dụng ion mẹ 206.1534 ±0.005 m/z (Hình 9A) và ion con 206.1534 > 130.0629 m/z (Hình 9B). Tín hiệu nền quan sát được khi sử dụng ion con để định lượng cho 4F-MDMB-BINACA 3,3 dimethylbutanoic và nhiều cannabinoid tổng hợp khác được giảm 1 cách rõ rệt. Kết hợp với sai số về số khối ( 1 ppm), điểm đối chiếu với thư viện phổ MS/MS (> 97%) và điểm combined score (> 96%) không những thể hiện độ tin cậy cao trong việc phát hiện 4F-MDMB-BINACA 3,3 dimethylbutanoic trong nền mẫu nước tiểu, mà còn cho phép tăng độ nhạy của phương pháp phân tích.
1 ppm), điểm đối chiếu với thư viện phổ MS/MS (> 97%) và điểm combined score (> 96%) không những thể hiện độ tin cậy cao trong việc phát hiện 4F-MDMB-BINACA 3,3 dimethylbutanoic trong nền mẫu nước tiểu, mà còn cho phép tăng độ nhạy của phương pháp phân tích.
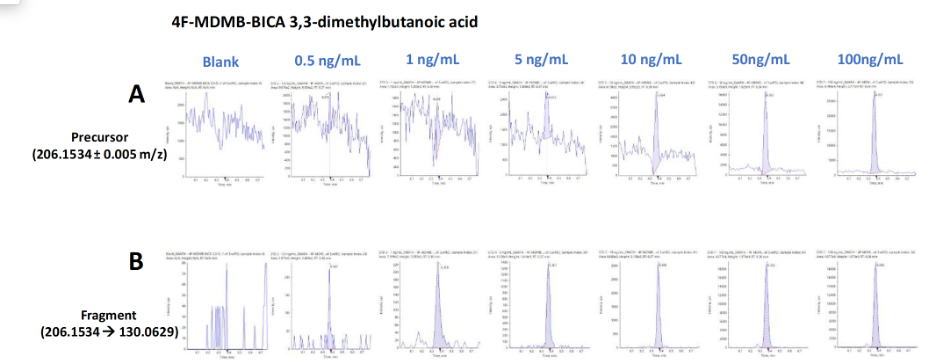
Hình 9. Đường chuẩn thu được của 4F-MDMB-BINACA 3,3 dimethylbutanoic acid sử dụng: A) ion mẹ, B) ion con.
Thẩm định phương pháp
Khả năng thu được kết quả với độ tái lặp và chính xác cao cho tất cả các mẫu trong tất cả các lần đo là vô cùng quan trọng để có thể thu được kết quả định lượng đáng tin cậy trong quy trình sàng lọc các NPS. Sự ổn định của vMethod trong ứng dụng liên quan tới sàng lọc độc học và pháp y trên hệ thống QTOF X500R được đánh giá sử dụng các mẫu chiết của mẫu nước tiểu và mẫu máu toàn phần với các mức nồng độ chất liên quan từ 0,5 – 100 ng.mL-1. Các mẫu lặp trong 3 ngày phân tích liên tiếp ở mức nồng độ 10 ng.mL-1 (n = 9) được sử dụng để đánh giá độ chụm của phương pháp trong ngày và giữa các ngày. Đường chuẩn của 130 NPS được thể hiện ở hình 10, mỗi điểm chuẩn được bơm lặp 3 lần/ngày, trong 3 ngày liên tiếp, tất cả các đường chuẩn của các NPS đều có giá trị R2 > 0,99, dù sử dụng kĩ thuật DDA hay DIA (Hình 10). Kết quả thể hiện độ chụm trong ngày và giữa 3 ngày đo rất tốt với giá trị %CV < 10% cho tất cả các điểm chuẩn. Các kết quả này chứng tỏ độ ổn định cao trong việc định lượng sử dụng cả 2 kĩ thuật DIA và DDA cho cả 2 loại mẫu nước tiểu và mẫu máu toàn phần. Bảng 1 và 2 tổng kết các kết quả thống kê thu được cho 130 NPS liên quan, bao gồm khoảng nồng độ làm việc, R2, cũng như độ chụm trong ngày và giữa các ngày ở mức nồng độ 10 ng.mL-1 (Bảng 1, 2).
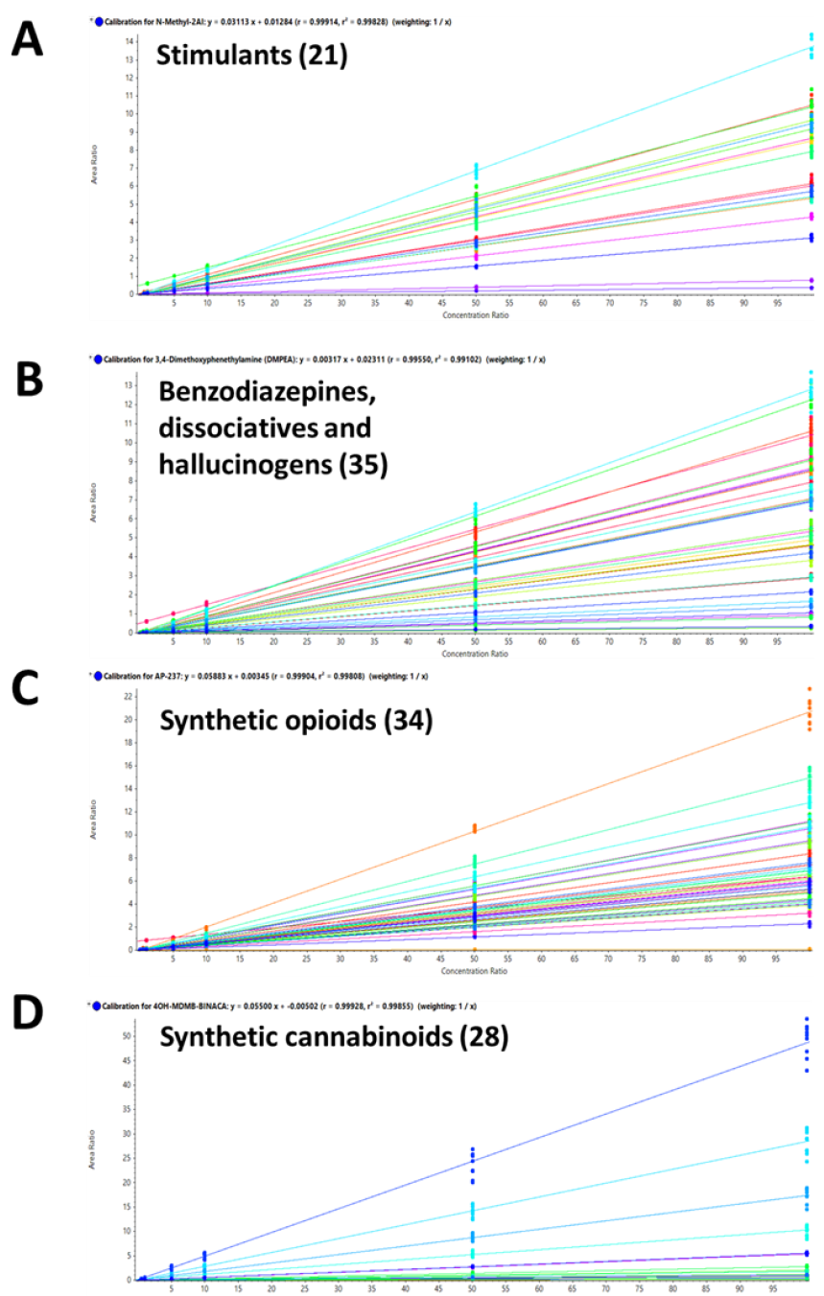
Hình 10. Đường chuẩn của 130 NPS, A) 22 chất kích thích, B) 35 benzodiazepines, chất phân ly và ảo giác; C) 34 opioid tổng hợp và D) 28 cannabinoid tổng hợp, bao gồm 2 cannabinoid, delta-8 THC và delta-8 carboxy THC.
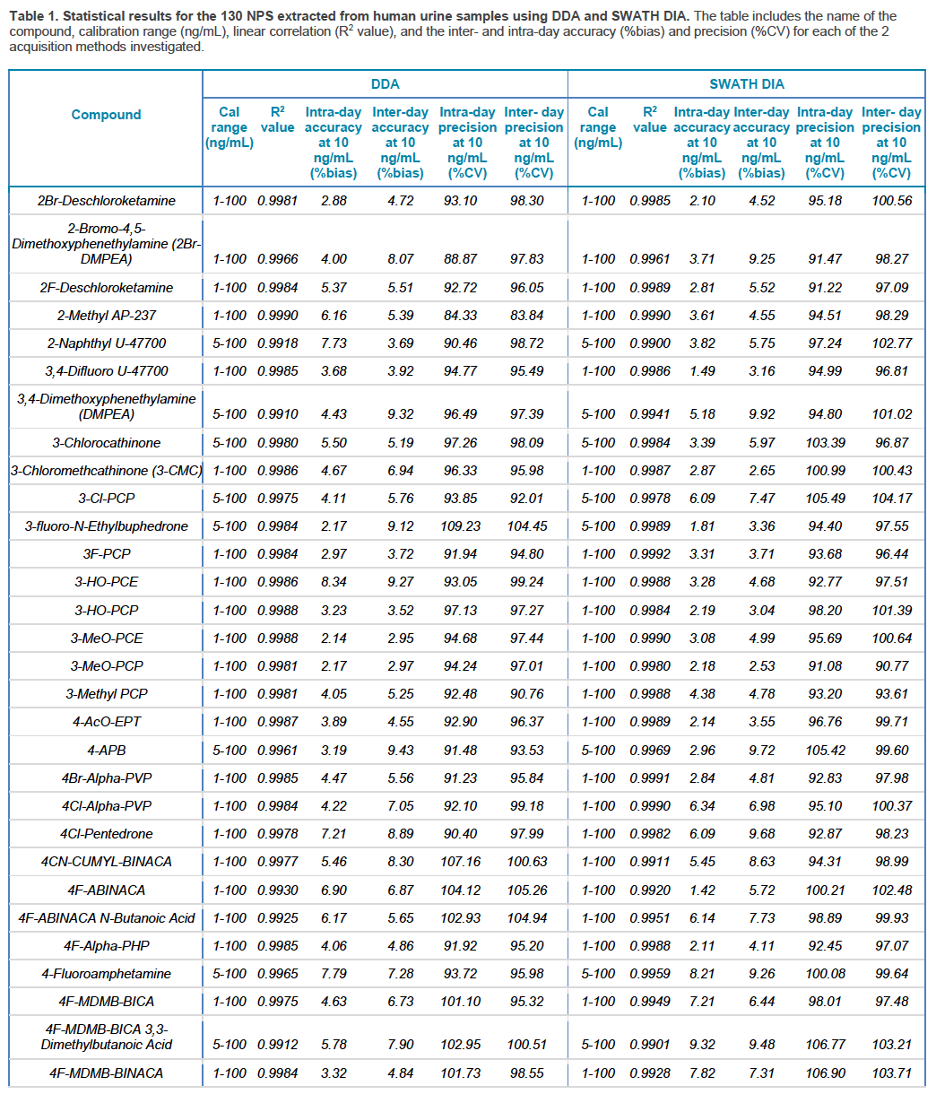
Xem bảng 1 đầy đủ tại https://sciex.com/tech-notes/forensic/toxicology/expanding-nps-screening-capabilities-in-the-forensic-toxicology-
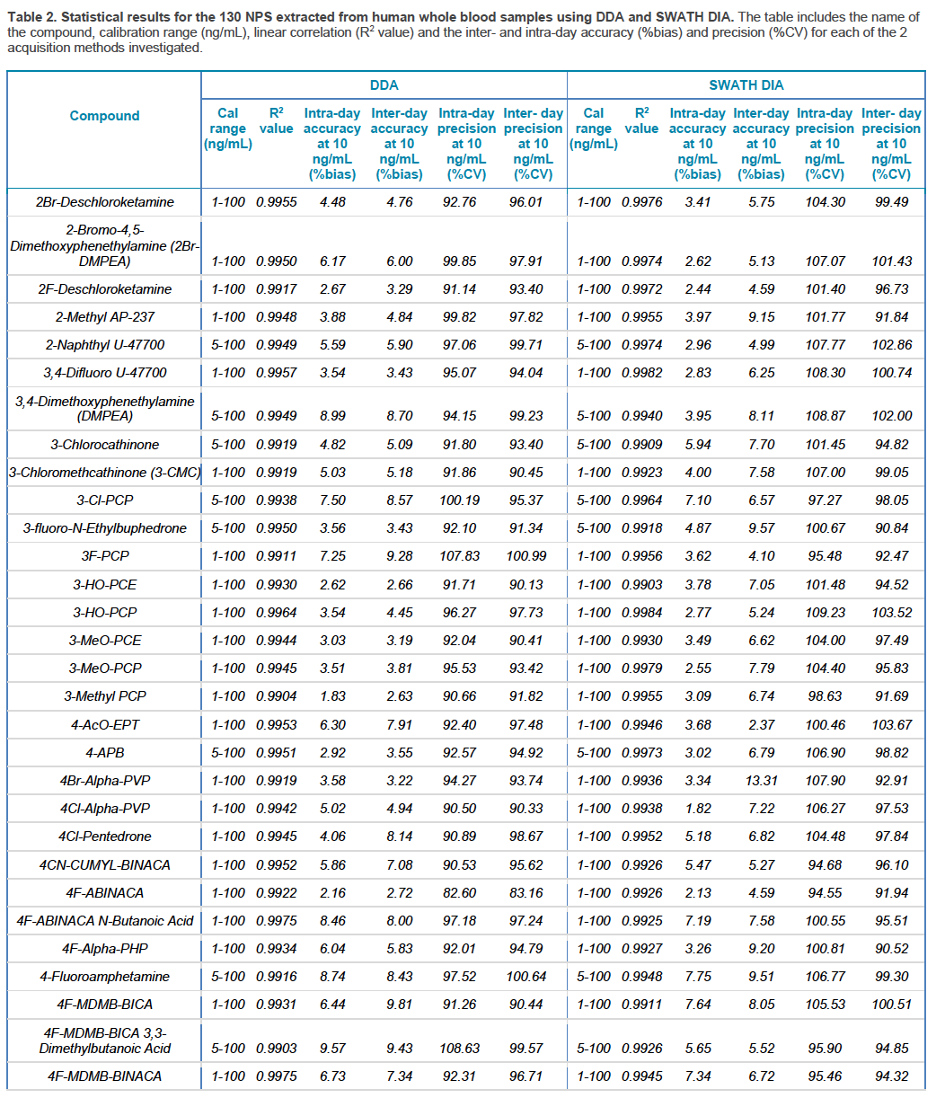 Xem bảng 2 đầy đủ tại https://sciex.com/tech-notes/forensic/toxicology/expanding-nps-screening-capabilities-in-the-forensic-toxicology-
Xem bảng 2 đầy đủ tại https://sciex.com/tech-notes/forensic/toxicology/expanding-nps-screening-capabilities-in-the-forensic-toxicology-
So sánh kết quả của SWATH DIA với DDA
Cả DDA và SWATH DIA đều là các kĩ thuật ghi tín hiệu không mục tiêu cho phép thu thập phổ MS và MS/MS chất lượng cao, cho phép định danh, xác định và đối chiếu với thư viện. Cả 2 kĩ thuật đều bắt đầu với việc ghi phổ MS của tất cả ion mẹ hiện diện trong mẫu trong khoảng khối được lựa chọn bởi người sử dụng (ví dụ: từ 50 – 800 Da). Tuy nhiên, DDA khác với SWATH DIA ở chỗ việc ghi phổ MS/MS chỉ được kích hoạt khi thông tin thu được từ survery MS scan phải phù hợp với 1 tiêu chí đã thiết lập trước (ví dụ: ion mẹ phải có tín hiệu vượt ngưỡng cường độ tín hiệu nhất định để tiến hành phân mảnh), thêm vào đó, người sử dụng phải quyết định số lượng ion mẹ tối đa có thể được phân mảnh (ví dụ: tối đa 20 ion mẹ) trong từng duty cycle (thời gian để thiết bị hoàn thành 1 lần đo, phân biệt với dwell time trên QqQ - thời gian để hoàn thành đo 1 MRM). Do đó, DDA có thể để lọt những hợp chất có tín hiệu thấp, hoặc không thể phân mảnh đc tất cả các chất phù hợp với tiêu chí đã đặt ra do mẫu quá phức tạp khi đó DDA sẽ ưu tiên phân mảnh những chất có tín hiệu cao trước.
Việc tham chiếu thư viện phổ MS/MS là phần quan trọng nhất của quy trình sàng lọc, vì phổ MS/MS cung cấp thông tin chi tiết về cấu trúc đặc thù của chất (như vân tay của mỗi người - fingerprint-like structural details) cho phép thực hiện việc đối chiếu với thư viện phổ MS/MS để định danh một cách tin cậy. Khả năng ghi phổ MS/MS cho các hợp chất có nồng độ thấp có thể hiện diện trong các mẫu sinh học phức tạp được đánh giá bằng cách so sánh tỷ lệ phát hiện dương tính giữa 2 kĩ thuật ghi dữ liệu DDA và SWATH DIA. Hình 11 thể hiện kết quả định danh của 2 chất PCE và 4F-MDMB-BINACA 3,3-dimethylbutanoic acid ở mức nồng độ thấp (5 ng.mL-1) được tiến hành bằng kĩ thuật ghi tín hiệu, (bên trái) kết quả của SWATH DIA và (bên phải) kết quả DDA/IDA. Trong đó, phổ MS/MS của 2 chất này chỉ được ghi nhận khi sử dụng kĩ thuật SWATH DIA, và qua đó xác nhận sự hiện diện của 2 chất này ở mức nồng độ thấp (Hình 11). Do với DDA, cường độ tín hiệu tương ứng của 2 chất này ở mức nồng độ thấp trong MS survery scan không đạt ngưỡng tín hiệu thiết lập để phân mảnh nên việc ghi phổ MS/MS đã không được kích hoạt. Kết quả này chỉ ra rằng, việc sử dụng kĩ thuật DDA trong việc định danh các chất liên quan có thể dẫn tới việc không đạt được độ tin cậy mong muốn.
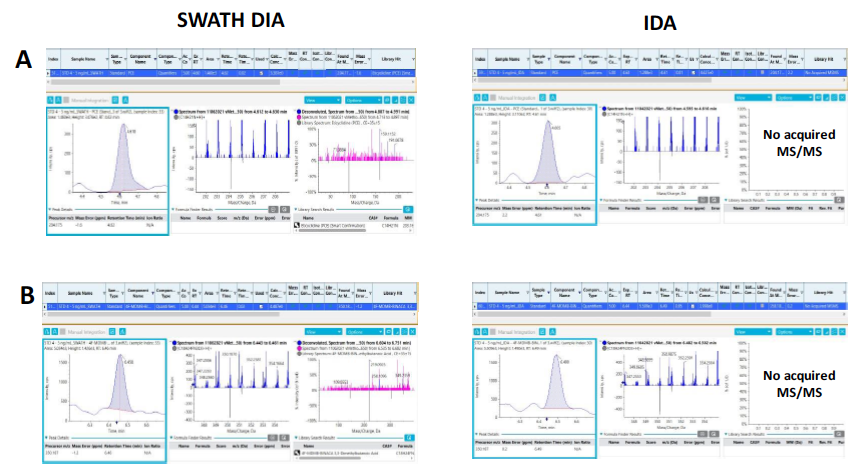
Hình 11. Phổ XIC, phổ MS và phổ MS/MS của PCE và 4F-MDMB-BINACA 3,3-dimethylbutanoic acid ở nồng độ 5 ng.mL-1 ghi bằng, (bên trái) SWATH DIA và (bên phải) DDA
Kết luận
Việc sử dụng quy trình xử lý mẫu và phân tích trong vMethod trong ứng dụng độc học và pháp y cho phép phân tích 130 NPS mới trong mẫu nước tiểu và máu toàn phần của người. Việc sử dụng hệ thống QTOF X500R kết hợp với kĩ thuật SWATH DIA cho phép định lượng 1 cách hiệu quả và cung cấp thông tin định danh đầy đủ các NPS liên quan. Thêm vào đó, phần mềm Sciex OS cung cấp các công cụ và các tiêu chí đánh giá dễ dàng và trực quan cho phép tiến hành sàng lọc nhanh và định danh các chất liên quan với độ tin cậy cao.
Tài liệu tham khảo
Kind, T., & Fiehn, O. (2006). Metabolomic database annotations via query of elemental compositions: mass accuracy is insufficient even at less than 1 ppm. BMC Bioinformatics, 7, 234. https://doi.org/10.1186/1471-2105-7-234
Kind, T., & Fiehn, O. (2007). Seven Golden Rules for heuristic filtering of molecular formulas obtained by accurate mass spectrometry. BMC Bioinformatics, 8, 105. https://doi.org/10.1186/1471-2105-8-105
Negri, P. (n.d.). Expanding NPS screening capabilities in the forensic toxicology laboratory Screen for over 900 compounds using the vMethod application on the SCIEX X500R QTOF system. Retrieved March 5, 2024, from https://sciex.com/tech-notes/forensic/toxicology/expanding-nps-screening-capabilities-in-the-forensic-toxicology-
Schymanski, E. L., Jeon, J., Gulde, R., Fenner, K., Ruff, M., Singer, H. P., & Hollender, J. (2014). Identifying Small Molecules via High Resolution Mass Spectrometry: Communicating Confidence. Environmental Science & Technology, 48(4), 2097–2098. https://doi.org/10.1021/es5002105