
Đang tải...

Đang tải...
Methods for Novel Psychoactive Substance Analysis, Methods in Pharmacology and Toxicology
Phương pháp phân tích các chất hướng thần mới, Phương pháp trong dược học và độc chất học
Chương 1: Phân tích Mục tiêu các Cannabinoid Tổng hợp trong Máu và Nước tiểu
Tác giả: Alex J. Krotulski
Biên soạn bởi
Marta Concheiro
Department of Sciences, John Jay College of Criminal Justice, City University of New York,
New York, NY, USA
Karl B. Scheidweiler
Scientific Affairs, Toxicology R&D, Abbot/Immunalysis, Pomona, CA, USA
Lời giới thiệu: Sau đây là bản tóm tắt lược dịch chương 1 từ cuốn sách: “Methods for Novel Psychoactive Substance Analysis, Methods in Pharmacology and Toxicology, của các biên tập Marta Concheiro và Karl B. Scheidweiler; DOI: https://doi.org/10.1007/978-1-0716-2605-4_1”. Người dịch, TS. Lê Sĩ Hưng, tốt nghiệp tiến sĩ tại đại học BOKU Vienna (Cộng hoà Áo) ngành hoá phân tích, đã có trên 10 năm kinh nghiệm làm việc với các thiết bị khối phổ, tập trung vào ứng dụng các kỹ thuật khối phổ trong phân tích các chất chuyển hoá (metabolites) và protein trong các đối tượng mẫu sinh học, ORCID: 0000-0002-0762-3492. Chương 1 này tập trung vào những thách thức và phương pháp phân tích mục tiêu các cannabinoid tổng hợp (SCs) trong máu và nước tiểu, một lĩnh vực phức tạp do sự đa dạng về cấu trúc hóa học và dược động học của SCs. Khác với các nhóm chất hướng thần mới (NPS) khác, SCs và chất chuyển hóa của chúng có tính chất hóa học biến đổi từ trung tính đến axit và có sự khác biệt giữa mẫu máu và nước tiểu, đòi hỏi các quy trình chiết xuất và phân tích chuyên biệt. LC-MS/MS là phương pháp phân tích mục tiêu phổ biến nhất do độ đặc hiệu, độ nhạy và tính linh hoạt cao, trong khi các phương pháp khác như GC-MS và xét nghiệm miễn dịch ít được sử dụng hơn. Quá trình phân tích bao gồm chuẩn bị mẫu (LLE, SPE hoặc kết tủa protein), định lượng với chất chuẩn, và phân tích dữ liệu sắc ký và khối phổ, trong đó việc hiểu rõ sự phân mảnh của các ion là rất quan trọng. Do đó, phân tích SCs đòi hỏi sự hiểu biết sâu rộng về hóa học, sinh học, và các kỹ thuật phân tích, đồng thời cần liên tục cập nhật kiến thức do sự thay đổi liên tục của các SCs.
Tóm tắt
Nhóm cannabinoid tổng hợp của các chất NPS (Chất hướng thần mới) vẫn là một trong những nhóm chất lớn nhất và phức tạp nhất về mặt hóa học và tính chất. Cần phải hiểu rõ một số yếu tố trước khi phát triển phân tích mục tiêu cho nhóm các thuốc này. Không giống như các nhóm NPS khác, các cannabinoid tổng hợp và chất chuyển hóa của chúng gồm các chất phân tích trung tính đến axit. Thêm vào đó các chất phân tích này có tính chất khác nhau trong mẫu máu và nước tiểu, đòi hỏi sự chú ý đặc biệt trước khi phát triển và thực hiện phương pháp phân tích. Do đó, các cannabinoid tổng hợp đòi hỏi các phương pháp chiết và phân tích đặc biệt để xác định đặc điểm của chúng. Chương này mô tả tất cả các khía cạnh liên quan đến phân tích mục tiêu của các cannabinoid tổng hợp, bao gồm các phương pháp chuẩn bị mẫu và các nền tảng dụng cụ. Các loại phân tích mục tiêu được thảo luận bao gồm sắc ký lỏng ghép khối phổ song song (LC-MS/MS) [được sử dụng phổ biến nhất], sắc ký khí ghép khối phổ (GC-MS), xét nghiệm miễn dịch và khối phổ độ phân giải cao (HRMS).
Từ khóa: Cannabinoid tổng hợp, LC-MS/MS, GC-MS, Xét nghiệm miễn dịch, LC-HRMS, Máu, Nước tiểu
1. Giới thiệu
Phân tích mục tiêu các cannabinoid tổng hợp có thể là một trong những khía cạnh thách thức nhất liên quan đến việc thử nghiệm các chất hướng thần mới (NPS). Các cannabinoid tổng hợp rất khác nhau về tính chất hóa học và dược động học so với các nhóm NPS khác. Điều này không cho phép các phòng thí nghiệm áp dụng các phương pháp thử nghiệm dựa trên nền tảng rộng hoặc các quy trình chuẩn bị mẫu đã được phát triển cho các nhóm chất khác cho nhóm cannabinoid tổng hợp. Từ việc thu thập mẫu đến giải thích dữ liệu, bao gồm tất cả các khía cạnh phân tích ở giữa, các cannabinoid tổng hợp đòi hỏi sự xử lý chuyên biệt và kinh nghiệm. Chương này sẽ tập trung vào các khía cạnh quan trọng liên quan đến phân tích mục tiêu của các cannabinoid tổng hợp trong máu và nước tiểu, đặc biệt tập trung vào việc chuẩn bị mẫu, các phương pháp phân tích và các cân nhắc cuối cùng.
Các cannabinoid tổng hợp được đưa vào thị trường thuốc giải trí vào khoảng năm 2008 khi các nhà khoa học bắt đầu ghi nhận sự xâm nhập của các loại thuốc mới này vào các vật liệu giống thực vật hoặc các chất nền khác vào Hoa Kỳ và Châu Âu [1]. Các cannabinoid tổng hợp đầu tiên là các chất bị đánh cắp từ các nghiên cứu học thuật và dược phẩm, cụ thể là từ Đại học Hebrew (Jerusalem, Israel), John W. Huffman (Đại học Clemson, SC), Alexandros Makriyannis (Đại học Northeastern, MA) và Pfizer (New York City, NY) [2]. Quá trình đánh cắp các phát hiện nghiên cứu hợp pháp và sử dụng thông tin làm bản thiết kế để phát triển "cơn sốt hợp pháp" tiếp theo là một thực hành phổ biến giữa các nhà hóa học và phòng thí nghiệm bí mật cho đến ngày nay. Kể từ khi thế hệ cannabinoid tổng hợp đầu tiên xuất hiện vào năm 2008, đã có hơn 200 cannabinoid tổng hợp mới được tổng hợp và đưa vào nguồn cung cấp thuốc giải trí [3-5]. Theo thời gian, cấu trúc của các loại thuốc này cũng đã phát triển. Hầu hết các cannabinoid tổng hợp đều giữ lại các đặc điểm chung, thường được gọi là đầu (head), lõi (core), đuôi (tail) và nhóm liên kết (link) (Hình 1), mặc dù một số trường hợp ngoại lệ tồn tại. Hiểu được quan điểm lịch sử này là điều cần thiết để đặt nền tảng cho việc phát triển và triển khai các phương pháp phân tích mục tiêu. Mặc dù nó sẽ không được đề cập chi tiết ở đây, những thay đổi trong cấu trúc cannabinoid tổng hợp cũng dẫn đến những thay đổi trong sự hoạt hóa và liên kết của thụ thể cannabinoid, điều này trước đây đã dẫn đến sự khác biệt lớn về hiệu lực và độc tính (ví dụ: HU-210 hoặc JWH-018 so với 5F-MDMB-PINACA hoặc MMB-FUBINACA).
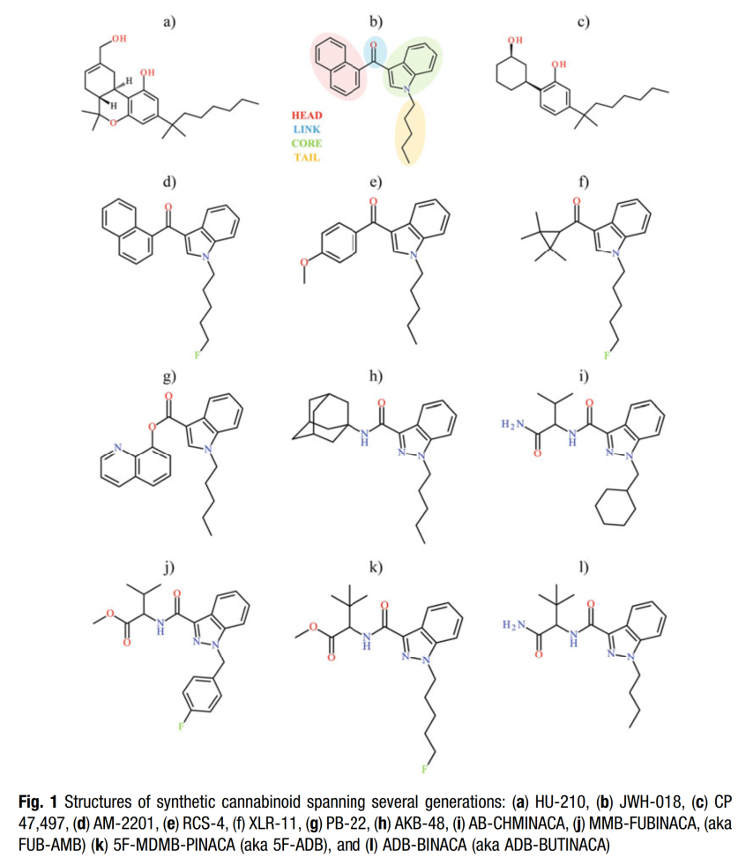
Các cannabinoid tổng hợp có thể được phân loại dựa trên vùng lõi và nhóm liên kết của chúng [6]. Các phân loại phổ biến bao gồm cyclohexylphenol (ví dụ: CP 47,497), naphthoylindole (ví dụ: JWH-018, AM-1120), benzoylindole (ví dụ: RCS-4), phenylacetylindole (ví dụ: JWH-250), alkylindole (ví dụ: UR-144, XLR-11), indole carboxylate (ví dụ: PB-22, NM-2201), indole carboxamide (ví dụ: 5F-APP-PICA, 5F-MMB-PICA), và indazole carboxamide (ví dụ: 5F-MDMB-PICA, MMB-FUBINACA), hai loại sau này được thấy phổ biến nhất vào cuối những năm 2010 và đầu những năm 2020. Mỗi phân loại này chứa các phân loại phụ bổ sung, và số lượng các biến thể cấu trúc dường như là vô tận. Tuy nhiên, thông tin quan trọng cần hiểu và ghi nhớ là những thay đổi này trong phân loại phụ (và cuối cùng là cấu trúc phụ) dẫn đến những thay đổi trong hóa học và do đó hành vi của các loại thuốc trong quá trình phân tích. Các phân loại phụ thế hệ đầu (tức là cyclohexylphenol, naphthoylindole, benzoylindole) không phân cực hơn về mặt hóa học, trong khi các thế hệ sau (tức là indole và indazole carboxamide) trung tính hơn về hành vi — mặc dù việc đánh giá cấu trúc tổng thể với các nhóm đầu và đuôi khác nhau là cần thiết cho hành vi hóa học cuối cùng.
Sự chuyển hóa của các cannabinoid tổng hợp là một khía cạnh quan trọng khác cần xem xét trước khi thảo luận về các phương pháp phân tích. Không giống như các nhóm NPS khác, các cannabinoid tổng hợp được chuyển hóa rộng rãi trong cơ thể người, dẫn đến việc có rất ít hoặc không có thuốc gốc còn lại trong nước tiểu (và đôi khi cả các mẫu sinh học khác). Điều này đòi hỏi các phòng thí nghiệm phải xét nghiệm rộng rãi các chất chuyển hóa cannabinoid tổng hợp, đến lượt nó lại đòi hỏi các nghiên cứu để xác nhận các chất chuyển hóa chính và phụ được tạo ra sau khi tiêu thụ cannabinoid tổng hợp. Tương tự như sự chuyển đổi của tetrahydrocannabinol (THC) thành các chất chuyển hóa của nó (ví dụ: THC-COOH), các cannabinoid tổng hợp thường được chuyển đổi thành các chất chuyển hóa phân cực hơn và "axit". Các chất chuyển hóa axit này, thường được gọi là axit butanoic hoặc N-pentanoic (dựa trên vị trí khác nhau của phân tử), cũng khác nhau rất nhiều về tính chất hóa học và hành vi so với thuốc gốc, làm phức tạp thêm các quy trình phân tích. Các chuyển đổi trao đổi chất phổ biến nhất để tạo ra các chất chuyển hóa chính ở người bao gồm thủy phân este (hoặc amit) và hydroxyl hóa, sau đó là carboxyl hóa. Ví dụ: JWH-018 được chuyển hóa để tạo ra axit N-pentanoic JWH-018 và 5F-MDMB-PINACA được chuyển hóa để tạo ra axit 3,3-dimethylbutanoic 5F-MDMB-PINACA (xem Hình 2) [7, 8]. Các chất chuyển hóa phân cực và có tính axit hơn này có thể yêu cầu các quy trình chuẩn bị mẫu và phương pháp phân tích riêng biệt và đặc biệt, chưa kể đến khả năng tạo ra các chất chuyển hóa thứ cấp (ví dụ: glucuronide).
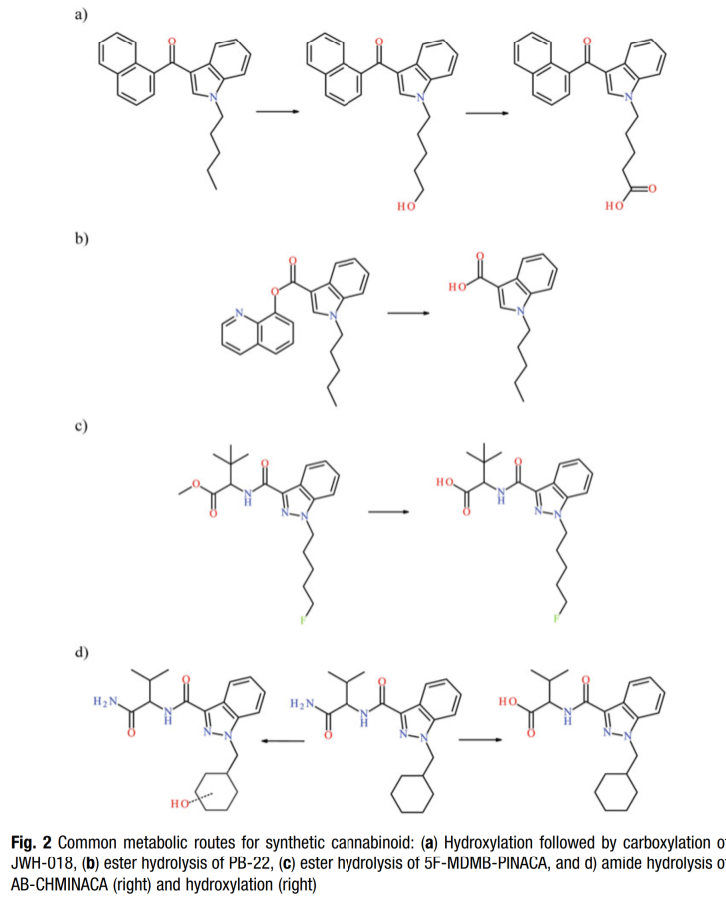
Một hiện tượng cuối cùng cần thảo luận về các cannabinoid tổng hợp là tính không ổn định đã được ghi nhận của chúng, vì điều này ảnh hưởng đến các cân nhắc khi phát triển các phân tích mục tiêu thích hợp. Các báo cáo nghiên cứu cho thấy rằng một số cannabinoid tổng hợp (đặc biệt là những chất có nhóm đầu este) có thể rất không ổn định ở các điều kiện bảo quản lạnh thông thường [9]. May mắn là quá trình phân hủy (ví dụ: thủy phân este) tương tự như quá trình trao đổi chất và các chất chuyển hóa được đặc trưng có thể được sử dụng để theo dõi hoặc giám sát tính không ổn định. Ví dụ: 5F-MDMB-PINACA rất không ổn định và phân hủy thành axit 3,3-dimethylbutanoic 5F-MDMB-PINACA khi được bảo quản trong máu ở điều kiện nhiệt độ phòng và lạnh. Tuy nhiên, hầu hết các phòng thí nghiệm không tìm kiếm chất chuyển hóa/sản phẩm phân hủy trong máu, vì vậy có thể bỏ lỡ các trường hợp dương tính. Cuối cùng, công việc nghiên cứu trước đây làm sáng tỏ sự cần thiết của các phương pháp phân tích để bao gồm hoặc xem xét các chất chuyển hóa không chỉ trong các mẫu nước tiểu.
Như vậy có thể hiểu, phân tích mục tiêu các cannabinoid tổng hợp trong máu và nước tiểu là một lĩnh vực phức tạp và độc đáo, khác nhiều so với các nhóm NPS khác. Không chỉ một nhà khoa học và phòng thí nghiệm cần phải xem xét bản chất đang phát triển của nhóm cannabinoid tổng hợp, mà họ còn cần phải tính đến các khía cạnh liên quan đến các quá trình sinh học — cả hai đều là những nhiệm vụ khó khăn đòi hỏi giáo dục, đào tạo, chuyên môn và tư duy đổi mới liên tục.
2. Các phương pháp phân tích có mục tiêu
Các phương pháp phân tích có mục tiêu (target analysis) trong các quy trình phân tích độc học và pháp y có thể được mô tả với 3 điểm chính trong quá trình phân tích: (1) Chuẩn bị mẫu và/hoặc chiết xuất, (2) phân tích với thiết bị và (3) xử lý số liệu. Mỗi điểm có thể được thiết kế các đối tượng hoặc đặc tính thuốc cụ thể (phụ thuộc vào dữ liệu/thông tin), hoặc một cách khác, mỗi phương pháp có thể được thiết kế để bao gồm nhiều loại thuốc và các phân tử liên quan đến thuốc trên một phổ rộng (còn được gọi là "không mục tiêu" hoặc không phụ thuộc vào dữ liệu/thông tin). Hình 3 phân tích cách các khía cạnh mục tiêu và không mục tiêu rơi vào các loại phân tích này. Chương này sẽ tập trung cụ thể vào các phương pháp phân tích công cụ mục tiêu nhưng sẽ thảo luận ngắn gọn về hai lĩnh vực tiếp tuyến khác.
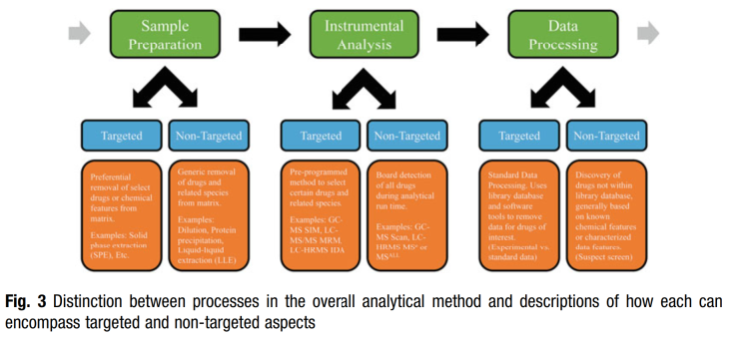
Trong độc học pháp y, phân tích mục tiêu có thể được sử dụng cho cả việc sàng lọc và xác nhận thuốc, mặc dù, trong kỷ nguyên hiện đại này khi khối phổ phân giải cao (HRMS) có sẵn, việc sàng lọc thuốc đã chuyển nhiều hơn sang các phương pháp không mục tiêu. Phân tích mục tiêu các cannabinoid tổng hợp thường được sử dụng thông qua sắc ký lỏng ghép khối phổ song song (tandem-MS) (LC-MS/MS), vì thiết bị này cung cấp mức độ đặc hiệu, độ nhạy và tính linh hoạt cao. Do cấu trúc thuốc và hiệu lực ngày càng thay đổi, xét nghiệm dựa trên xét nghiệm miễn dịch và sắc ký khí ghép khối phổ (GC-MS) hiếm khi được sử dụng.
2.1. Chuẩn bị mẫu
Trước khi thảo luận về cách một phòng thí nghiệm sử dụng phân tích công cụ để phát hiện các cannabinoid tổng hợp, cần có một sự kiểm tra ngắn gọn về các kỹ thuật chuẩn bị mẫu. Có ba cách chung để loại bỏ các cannabinoid tổng hợp khỏi vật liệu sinh học để phân tích: (1) chiết lỏng-lỏng (LLE), (2) chiết pha rắn (SPE) và (3) kết tủa protein đối với máu hoặc pha loãng đơn giản đối với nước tiểu. Các quy trình LLE có thể hiệu quả để loại bỏ đơn giản và nhiều các loại thuốc khỏi chất nền; tuy nhiên, độ pH đơn (singular pH) và dung môi đa dụng (universal sovlent) có thể dẫn đến bỏ sót các cannabinoid tổng hợp được quan tâm hoặc mẫu chiết xuất không sạch với mức độ nền cao, tương ứng. LLE thường được sử dụng cho các phương pháp chiết xuất không mục tiêu, có thể kết hợp tốt với phân tích mục tiêu. SPE thường tạo ra mẫu chiết sạch hơn; tuy nhiên, việc phát triển các quy trình SPE có thể mất nhiều thời gian và phức tạp hơn LLE. SPE cũng có thể phục vụ cho các tính chất hóa học khác nhau, nếu cần. Các phương pháp chuẩn bị mẫu sử dụng kết tủa protein và pha loãng thường là đơn giản và rẻ nhất; tuy nhiên, các vấn đề có thể phát sinh vì chúng tạo ra các mẫu "bẩn" để bơm vào thiết bị. Vấn đề về tính chọn lọc chiết xuất không phải là vấn đề với hai phương pháp này (kết tủa protein và pha loãng mẫu). Một số phương pháp chuẩn bị mẫu và chiết xuất đã được công bố tồn tại đối với các cannabinoid tổng hợp, một số trong số đó thay đổi dựa trên thế hệ thuốc được phân tích và tính chất hóa học của chúng.
Khi nhắm mục tiêu vào các thuốc gốc cannabinoid tổng hợp, các quy trình LLE thường sử dụng dung dịch đệm có độ pH khoảng 9-10 (hoặc đôi khi thấp hơn) để làm cho các cannabinoid tổng hợp không bị ion hóa, và di chuyển sang dung môi hữu cơ [10–14]. Thành phần và cường độ của đệm có thể thay đổi rất nhiều tùy thuộc vào phòng thí nghiệm đang phát triển phương pháp, điều này không phải là không phổ biến khi thảo luận về LLE. Vì các cannabinoid tổng hợp có tính chất hóa học không phân cực, dung môi hữu cơ sẽ bao gồm một dung môi duy nhất hoặc hỗn hợp các dung môi có độ phân cực cao (ví dụ: hexane) với độ phân cực trung bình hơn (ví dụ: ethyl acetate, MTBE). Khi nhắm mục tiêu vào các chất chuyển hóa cannabinoid tổng hợp, không thể sử dụng các quy trình LLE tương tự vì các chất chuyển hóa thường có tính axit và phân cực hơn. Việc điều chỉnh pH của các mẫu có tính axit, làm cho các chất chuyển hóa không bị ion hóa để di chuyển sang lớp hữu cơ. Tương tự, lớp hữu cơ thường là hỗn hợp các dung môi rất không phân cực và hơi phân cực.
Do bản chất mục tiêu của chúng, có nhiều quy trình SPE được sử dụng để chiết xuất các cannabinoid tổng hợp từ các chất nền, tất cả đều khác nhau rất nhiều dựa trên mục đích sử dụng dự định [10, 15–22]. SPE pha đảo và SPE trao đổi ion là phổ biến, cũng như các SPE chế độ hỗn hợp sử dụng sự kết hợp của cả hai.
2.2 Định lượng
Cũng như định lượng bất kỳ loại thuốc hoặc NPS nào, hiệu lực của thuốc thường quyết định phạm vi động cần thiết để đánh giá nồng độ thuốc. Điều này cũng đúng đối với các cannabinoid tổng hợp, mặc dù các thế hệ gần đây có hiệu lực cao hơn (so với các thế hệ cũ hơn) dẫn đến các giá trị định lượng thấp hơn trong các mẫu sinh học của người. Phân tích định lượng đối với các cannabinoid tổng hợp trong máu và nước tiểu thường dao động từ 0,1 đến 10 ng/mL (ppb), 0,5 đến 50 ng/mL hoặc 1 đến 100 ng/mL; tuy nhiên, điều này phụ thuộc nhiều vào quy trình và chính sách của phòng thí nghiệm, cũng như kinh nghiệm và đầu vào của nhà khoa học.
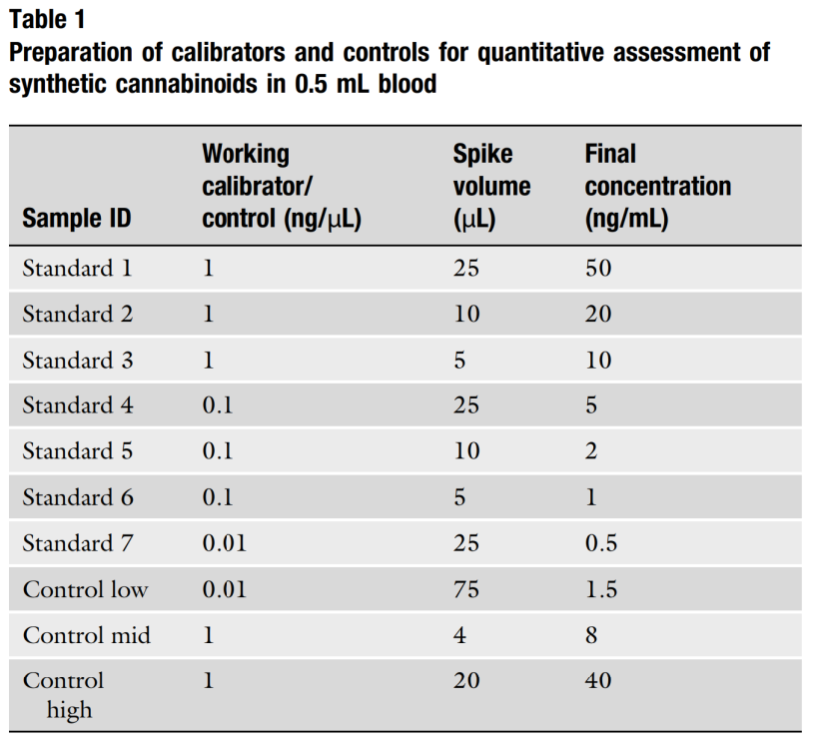
Một phương pháp tiếp cận phổ biến để định lượng là sử dụng 0,5 mL mẫu sinh học và thêm các chất chuẩn giữa 0,5 và 50 ng/mL và các chất kiểm soát tương ứng. Bảng 1 cho thấy một ví dụ chuẩn bị cho việc phân tích định lượng các cannabinoid tổng hợp.
Như đã đề cập trước đó, LC-MS/MS là thiết bị phân tích được sử dụng phổ biến nhất để phát hiện các cannabinoid tổng hợp trong máu và nước tiểu. Theo dõi phản ứng đa (MRM) được sử dụng phổ biến nhất để phát hiện chính xác sự chuyển đổi của ion tiền chất thành ion sản phẩm, tương tự như cách thiết bị này được sử dụng để thử nghiệm thuốc trong các lĩnh vực khác của độc chất học pháp y. Kỹ thuật này được chia thành các phần nhỏ để thảo luận: sắc ký lỏng (tách), khối phổ tứ cực song song (phát hiện) và xử lý dữ liệu.
Bản chất không phân cực của các thuốc gốc cannabinoid tổng hợp có thể yêu cầu các phương pháp tách sắc ký chuyên biệt. Thông thường, sắc ký pha đảo được sử dụng trong các thử nghiệm độc chất học pháp y, bao gồm việc sử dụng pha động phân cực và pha tĩnh không phân cực. Vì các thuốc gốc cannabinoid tổng hợp thường có tính không phân cực cao (highly non-polar), điều này có nghĩa là phải đặc biệt chú ý đến việc phát triển các phương pháp để rửa giải các chất phân tích không phân cực này khỏi pha tĩnh không phân cực trong một khoảng thời gian hợp lý. Vì THC cũng rất không phân cực (và không phân cực hơn hầu hết các cannabinoid tổng hợp), loại thuốc này có thể được sử dụng để so sánh khi đánh giá một số hành vi sắc ký khó nhất (thời gian rửa giải muộn nhất). Rửa giải các cannabinoid tổng hợp trong các hệ thống sắc ký pha đảo có thể yêu cầu thành phần pha động hữu cơ phần trăm cao, sử dụng các pha động hữu cơ ít phân cực hơn và/hoặc tăng thời gian giữ ở thành phần hữu cơ cao. Quá trình này là "thử và sai" (trial and error) trong giai đoạn phát triển phương pháp. Chú ý rằng, các nhóm NPS khác có hành vi khác nhau trong các môi trường hóa học này, vì vậy những điều kiện tốt nhất cho các cannabinoid tổng hợp có thể không tốt cho tất cả các NPS và ngược lại.
Cũng như tất cả các khía cạnh của thử nghiệm cannabinoid tổng hợp, tách sắc ký không đơn giản như vậy. Các chất chuyển hóa cannabinoid tổng hợp có thể khác nhau rất nhiều về hành vi hóa học so với thuốc gốc, phần lớn là do những thay đổi trong cấu hình nhóm chức năng và do đó độ phân cực tổng thể của phân tử. Các chất chuyển hóa này, chứa các nhóm hydroxy và carboxy, bị hút nhiều hơn về phía pha động phân cực so với thuốc gốc, dẫn đến thời gian tương tác ngắn hơn với pha tĩnh không phân cực và cuối cùng là thời gian rửa giải ngắn hơn. Nếu một phòng thí nghiệm quan tâm đến việc phát hiện cả thuốc gốc và chất chuyển hóa trong một phương pháp sắc ký duy nhất, điều này có nghĩa là phải chú ý đến cả các thuốc gốc không phân cực rửa giải muộn và các chất chuyển hóa phân cực hơn rửa giải từ sớm đến giữa. Điều này có thể khó khăn tùy thuộc vào hệ thống sắc ký được sử dụng và thiết lập tổng thể (tức là cột, pha động, thời gian chạy).
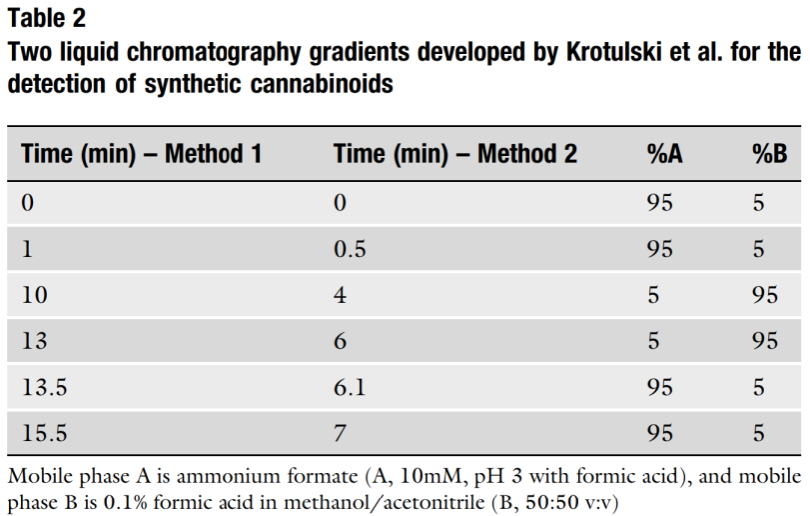
Bảng 2 và 3 cho thấy hai sự tách sắc ký đã được phát triển và sử dụng thành công để phát hiện các cannabinoid tổng hợp. Bảng 2 trình bày chi tiết một phương pháp sàng lọc dựa trên nền tảng rộng tiêu chuẩn hơn được phát triển bởi Krotulski và cộng sự [10, 23], bắt đầu ở phần trăm nước cao và chuyển sang phần trăm hữu cơ cao theo thời gian. Cột phân tích được sử dụng là cột phân tích Phenom-enex® Kinetex C18 (50 mm × 3,0 mm, 2,6 µm). Tổng thời gian chạy là 15,5 phút. Bảng 3 trình bày chi tiết một phương pháp tách sắc ký chuyên biệt hơn cho JWH-018 và các chất chuyển hóa của nó, được phát triển bởi Ridgon và cộng sự [24]. Trái ngược với phương pháp được mô tả đầu tiên, phương pháp này sử dụng gradient pha động nhấn mạnh hơn vào pha hữu cơ. Cần lưu ý rằng trong khi phương pháp này có thể hoạt động cho việc tách sắc ký các cannabinoid tổng hợp khác, nó có thể không lý tưởng hoặc phù hợp cho tất cả.

2.3.2. Khối phổ ba tứ cực
Phân tích mục tiêu các cannabinoid tổng hợp đòi hỏi sự phát triển của các phương pháp phân tích mục tiêu được thiết kế để phát hiện các khối lượng nhất định liên quan đến các loại thuốc được quan tâm. Điều này trước tiên đòi hỏi việc thu thập thông tin này để xác minh sau này. Các tiêu chuẩn thuốc cho các cannabinoid tổng hợp được truyền vào — một quy trình mà thuốc được tiêm trực tiếp — vào khối phổ kế để đánh giá hành vi của chúng. Đầu tiên, ion tiền chất (hoặc khối đơn đồng vị (monoisotopic mass) được tính dựa trên công thức phân tử của một loại thuốc) được phát hiện thông qua quét MS1 đơn giản trong tứ cực đầu tiên (Q1). Thứ hai, ion tiền chất này được đưa qua một loạt các thử nghiệm để xác định các điều kiện tối ưu (ví dụ: điện áp, dòng khí) để phát hiện. Thứ ba, ion tiền chất bị phân mảnh (Q2) và các ion sản phẩm kết quả được phát hiện thông qua quét MS2 trong Q3. Trong quá trình này, các điều kiện tối ưu bổ sung có thể được kiểm tra. Cuối cùng, tất cả thông tin này được biên soạn lại để thử nghiệm như một phương pháp phân tích đã được phát triển.
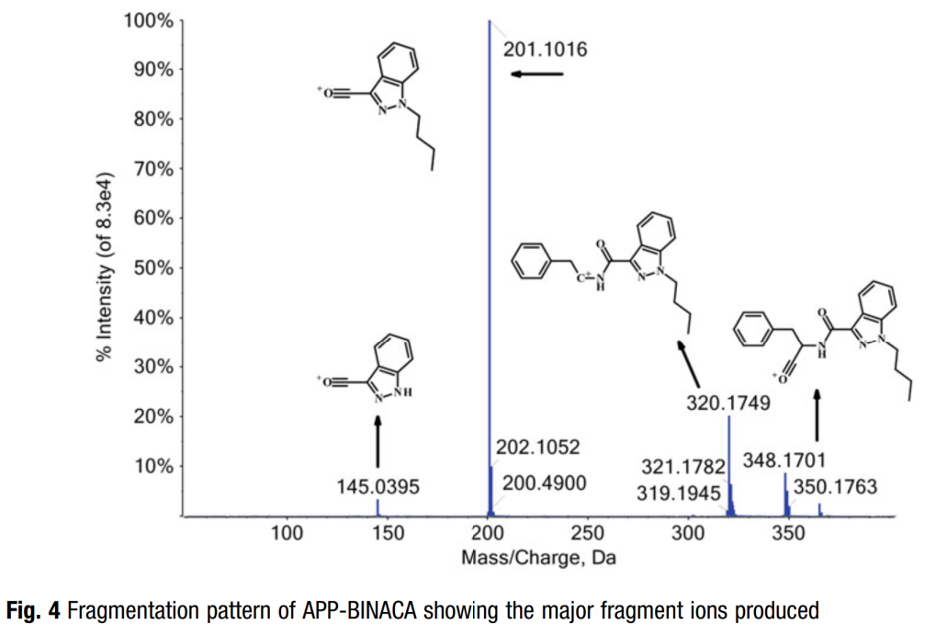
Điểm yếu nhất trong cấu trúc lõi cannabinoid tổng hợp thường là nhóm liên kết — một yếu tố quan trọng thúc đẩy cách các loại thuốc này phân mảnh. Phổ khối cho hầu hết các cannabinoid tổng hợp bao gồm một đỉnh đáy lớn và một số ion nhỏ hơn (xem Hình 4 cho APP-BINACA). Píc đáy tương quan với sự phân mảnh này tạo ra một ion giữ lại nguyên tử oxy của nhóm liên kết (để tạo thành một ion acylium), lõi và đuôi. Một ion mảnh vỡ chung khác là kết quả của việc loại bỏ đuôi khỏi ion này và có thể được phát hiện là ion 144 hoặc 145, tương ứng cho lõi indole và indazole. Thông tin này rất quan trọng để hiểu vì các chuyển tiếp MRM được chọn để phân tích mục tiêu thường phát sinh từ các sự phân cắt phân tử này.
Vì các cannabinoid tổng hợp có thể được tìm thấy ở nồng độ thấp (<5 ng/mL), một số tối ưu hóa khối phổ bổ sung có thể được yêu cầu. Tuy nhiên, có nhiều nhà cung cấp thiết bị khác nhau với phần cứng, phần mềm và tên gọi khác nhau cho một số dòng khí và điện áp, điều này gây khó khăn trong việc giải thích trong phạm vi ngắn gọn của chương này. Ngoài ra, những tiến bộ về công nghệ và phần cứng bổ sung sẽ khiến cuộc thảo luận này nhanh chóng trở nên lỗi thời. Luôn luôn khuyến khích người dùng thiết bị phân tích làm quen với tất cả các khía cạnh này trước khi phát triển phương pháp.
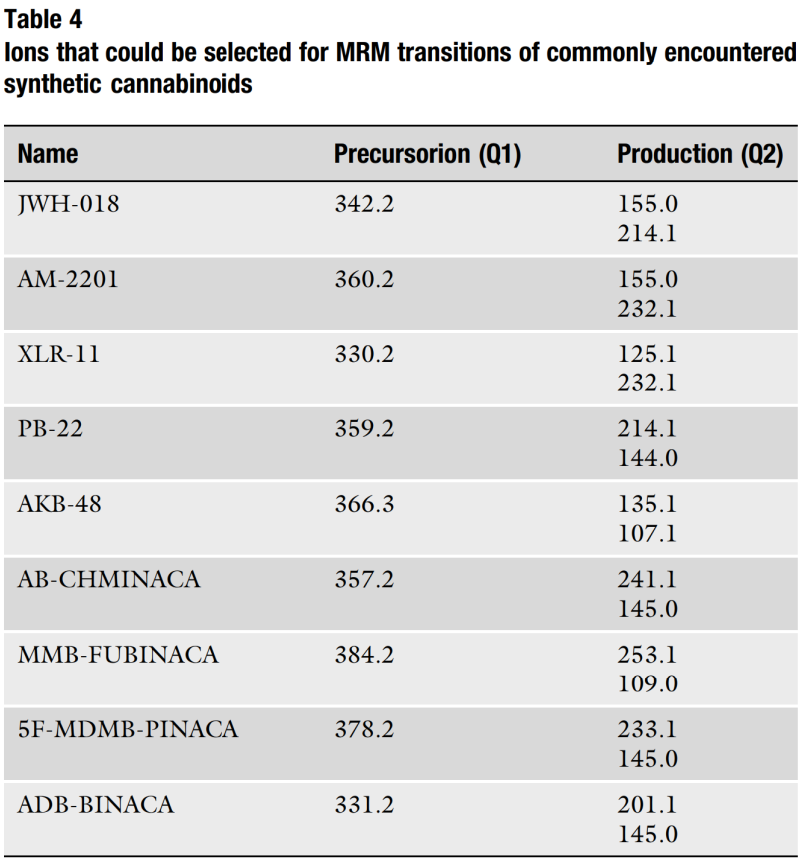
Bảng 4 cung cấp danh sách các cannabinoid tổng hợp thường gặp trước đây và các điểm cài đặt máy khối phổ của chúng. Điều này bao gồm tên, ion tiền chất và ion sản phẩm. Phân tích mục tiêu thường bao gồm ít nhất hai chuyển tiếp từ ion tiền chất đến ion sản phẩm.
Phân tích dữ liệu để thử nghiệm mục tiêu các cannabinoid tổng hợp nói chung tương đối đơn giản và tuân theo các phương pháp mục tiêu thông thường trong độc học pháp y. Hành vi sắc ký được đánh giá dựa trên thời gian lưu giữ (RT) và hình dạng píc. Không có hướng dẫn đặt ra cho các tiêu chí này, nhưng nói chung RT từ một mẫu chính hãng phải rất gần với RT của các chất chuẩn hoặc mẫu kiểm soát và hình dạng đỉnh phải là Gaussian [25]. Các độ lệch trong RT cho bất kỳ hệ thống sắc ký nào sẽ phụ thuộc vào công nghệ được sử dụng (tức là UPLC so với HPLC) và tổng thời gian chạy. Hiện tại trong độc chất học pháp y hiện đại với sự ra đời của UPLC, RT không nên lệch quá 0,05–0,1 phút trên một lần chạy hoặc một lô. Tuy nhiên, khi các phương pháp tăng thời gian chạy (>15 phút), các phòng thí nghiệm có thể thấy nhiều biến động hơn.
Một tính năng sắc ký bổ sung cần được theo dõi là tỷ lệ ion — tỷ lệ diện tích đỉnh cho chuyển tiếp ion tiền chất-sản phẩm số 1 sang số 2. Về bản chất, giá trị này sẽ phụ thuộc vào cường độ của các ion sản phẩm được chọn và các thông số cài đặt khối phổ. Hầu hết các hướng dẫn sẽ cho thấy rằng tỷ lệ ion nằm trong khoảng từ 20% đến 30% mục tiêu (tức là các chất chuẩn, chất kiểm soát). Tỷ lệ ion vẫn là một phần dữ liệu quan trọng để truy cập khi sử dụng các hệ thống tứ cực ba vì giá trị này có thể giúp phân biệt thuốc được quan tâm với các chất gây nhiễu.
Với phân tích mục tiêu LC-MS/MS, không có dữ liệu phổ khối nào tự nó được đánh giá một cách tổng quát, mặc dù việc bổ sung các quét MS2 (thông qua tứ cực hoặc bẫy ion) có thể được quan tâm. Trong những trường hợp đó, các so sánh thư viện có thể bao gồm các tiêu chí riêng của chúng và cung cấp mức độ chắc chắn cao hơn để nhận dạng tích cực.
Với những tiến bộ của độc chất học pháp y hiện đại, phân tích GC-MS ít được sử dụng hơn, đặc biệt là đối với việc phát hiện NPS và các cannabinoid tổng hợp. GC-MS thường không cung cấp độ nhạy phân tích cần thiết để phát hiện các hợp chất gốc cannabinoid tổng hợp có nồng độ thấp và bản chất của thiết lập thiết bị thường yêu cầu sử dụng quá trình dẫn xuất hoá (derivatization) cho các chất chuyển hóa cannabinoid tổng hợp có các nhóm chức năng phân cực chứa hydro hoạt động.
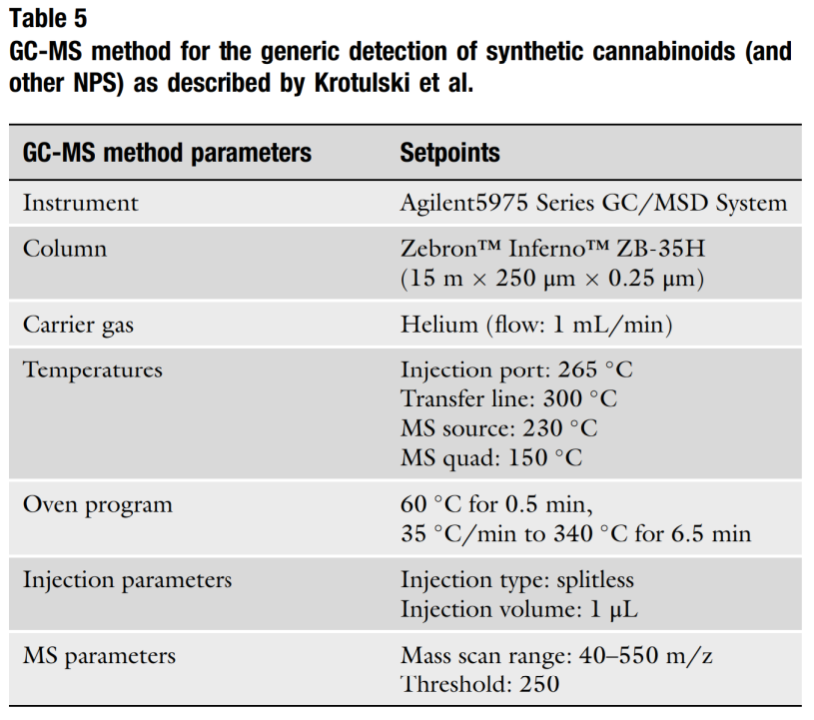
Sắc ký khí thường được triển khai sử dụng khí mang trơ (ví dụ: heli) và pha tĩnh không phân cực (ví dụ: silica liên kết hydrocacbon). Các cannabinoid tổng hợp có tính chất hóa học không phân cực, vì vậy quá trình sắc ký này dẫn đến sự tương tác nhiều hơn với pha tĩnh và do đó thời gian lưu giữ lâu hơn. Một ví dụ về phương pháp sắc ký khí được thể hiện trong Bảng 5 được sử dụng để phát hiện 4F-MDMB-BINACA và các cannabinoid tổng hợp khác [26]. Giống như tất cả các hệ thống phân tích, có nhiều phương pháp để tách sắc ký các chất được quan tâm và các phương pháp này sẽ phụ thuộc nhiều vào thiết bị, nhu cầu và sở thích của phòng thí nghiệm.
Phân tích mục tiêu của khối phổ tứ cực đơn (vd: GC-MS) đối với các cannabinoid tổng hợp có thể được phát triển bằng cách sử dụng chế độ quét (full scan) hoặc theo dõi ion chọn lọc (SIM) - trong đó tất cả các khối lượng được thu thập trên toàn bộ phạm vi khối hoặc chỉ các ion được chọn, tương ứng. Việc thu thập dữ liệu bằng chế độ quét cho phép tìm kiếm thư viện trong khi dữ liệu SIM được đánh giá bằng cách đánh giá tỷ lệ ion. Đối với các cannabinoid tổng hợp, các ion mảnh tương tự được thấy với LC-MS/MS [ESI +] ở trên thường cũng được thấy với GC-MS [EI] (điều này đôi khi không đúng với các loại thuốc khác). Các ion tương tự đó có khả năng hữu ích cho việc thiết lập phương pháp SIM nhưng nên được đánh giá thích hợp hơn trong bối cảnh của phương pháp và mục đích sử dụng của nó. Sau khi thu thập, dữ liệu được xử lý theo cách tương tự như trên nhưng trong các thiết bị hoặc phần mềm các quan điểm khác nhau.
2.5. Xét nghiệm miễn dịch
Xét nghiệm miễn dịch hiếm khi được sử dụng cho phân tích mục tiêu các cannabinoid tổng hợp do tính hữu dụng thấp và không có phản ứng chéo với các bộ xét nghiệm truyền thống [27]. Việc sử dụng xét nghiệm miễn dịch như một công cụ để phát hiện NPS phụ thuộc vào ý tưởng về phản ứng chéo này — hoặc nhận được kết quả dương tính đối với một loại thuốc mà xét nghiệm không được thiết kế để phát hiện. Với các thế hệ đầu (ví dụ: JWH-018), các xét nghiệm miễn dịch đã được phát triển để hỗ trợ sàng lọc mục tiêu [28, 29], cho dù trong môi trường lâm sàng hay pháp y, nhưng sự phát triển của các xét nghiệm này nhanh chóng mất đi chu kỳ và sự ưa chuộng do thời gian phát triển lâu hơn so với vòng đời của thuốc trên thị trường hoặc ít nhất là quá dài để nắm bắt các trường hợp gia tăng và tính dương tính đỉnh điểm. Các xét nghiệm miễn dịch hoạt động dựa trên sự phát triển của các kháng thể phản ứng với thuốc như kháng nguyên của chúng. Sự đa dạng cấu trúc giữa các cannabinoid tổng hợp ảnh hưởng đến cách các kháng thể được tạo ra có thể phản ứng với các thay đổi cấu trúc mới. Đây không phải là một hiện tượng mới đối với NPS, mà là một hiện tượng hữu ích cho một số nhóm khác. Ví dụ, các opioid tổng hợp mới không phản ứng chéo với các bộ xét nghiệm opioid truyền thống (morphine), trong khi một số benzodiazepine mới cho thấy phản ứng chéo tốt với các bộ xét nghiệm benzodiazepine truyền thống (temazepam). Vì những lý do này, phân tích mục tiêu các cannabinoid tổng hợp bị chi phối bởi việc sử dụng khối phổ.
2.6. Sắc ký lỏng ghép nối khối phổ phân giải cao
Trọng tâm của chương này là phân tích mục tiêu các cannabinoid tổng hợp và các phương pháp sàng lọc được mô tả ở Chương 11. Tuy nhiên, điều quan trọng là phải hiểu rằng việc sử dụng khối phổ phân giải cao (HRMS) thường thông qua phân tích mục tiêu, cho dù trong quá trình thu nhận thiết bị hoặc xử lý dữ liệu. Các chế độ thu nhận phụ thuộc vào dữ liệu phổ biến (DDA) (còn được gọi là thu nhận phụ thuộc thông tin [IDA]) được thiết kế như các phân tích mục tiêu dựa trên các tiêu chí nhất định. Các tiêu chí này có thể bao gồm m/z, thời gian lưu và/hoặc cường độ. Tóm lại, thiết bị sẽ chỉ thu nhận các yếu tố nhất định của dữ liệu (tức là phổ MS/MS) cho các chất phân tích đáp ứng các tiêu chí trong thời gian chạy. Krotulski và cộng sự đã mô tả chi tiết thông tin này, đặc biệt so sánh các chế độ thu nhận mục tiêu và không mục tiêu [23].
Một khó khăn nữa là cách dữ liệu được xử lý cho các phân tích HRMS. Ngay cả khi dữ liệu được thu thập theo phương thức không mục tiêu, việc xử lý dữ liệu của các tệp dữ liệu HRMS gần như được thực hiện độc quyền thông qua phân tích mục tiêu (một số trường hợp ngoại lệ chắc chắn được áp dụng). Các phòng thí nghiệm xử lý dữ liệu theo cách có mục tiêu do lượng dữ liệu quá lớn được thu thập trong quá trình phân tích HRMS. Nếu bạn nghĩ lại về LC-MS/MS, thiết bị chỉ thu thập dữ liệu cho những gì bạn yêu cầu. Với HRMS, thiết bị có thể thu thập hàng nghìn đến hàng triệu điểm dữ liệu, vì vậy xử lý dữ liệu có mục tiêu thường là phương tiện hợp lý duy nhất để diễn giải các tệp dữ liệu lớn phức tạp này. Thông thường, việc xử lý dữ liệu mục tiêu cho các cannabinoid tổng hợp được thực hiện thông qua dung sai xung quanh các tiêu chí đã đặt. Các tiêu chí này bao gồm khối lượng (từ công thức), thời gian lưu giữ, tỷ lệ đồng vị và/hoặc điểm đối chiếu thư viện. Krotulski và cộng sự đã mô tả các tiêu chí này chi tiết hơn ở một nơi khác [10, 23]. Các tiêu chí được sử dụng để xử lý dữ liệu mục tiêu được hiển thị trong Bảng 6.
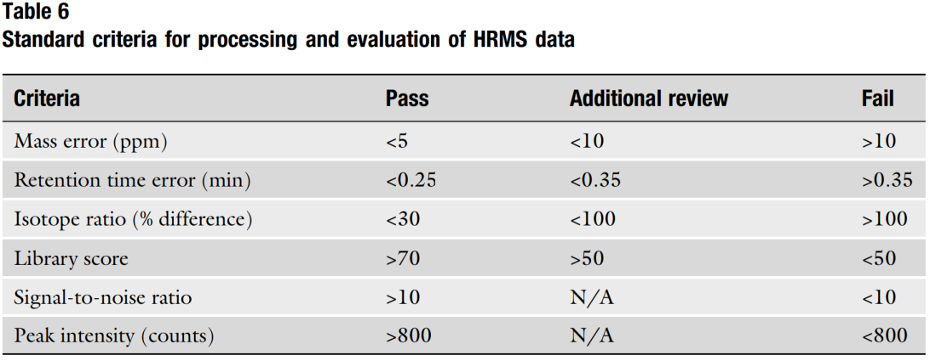
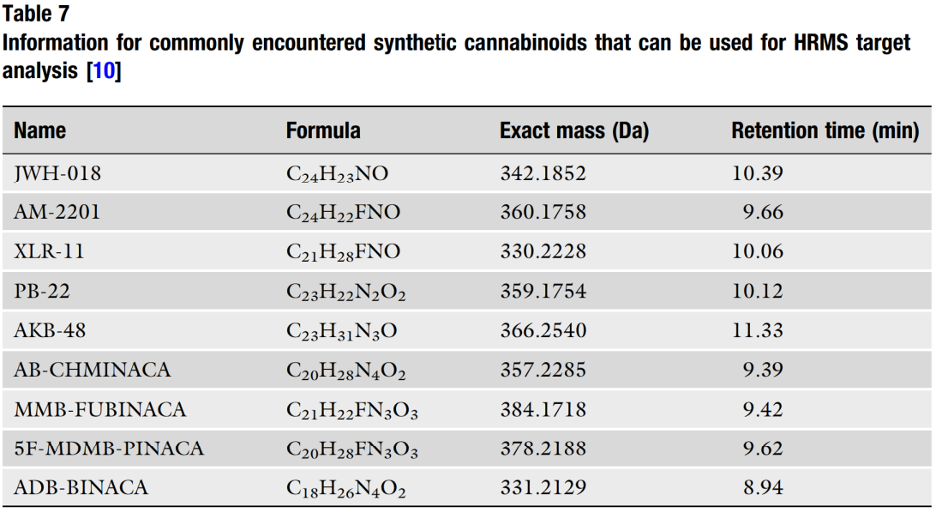
Như đã đề cập, khi sử dụng HRMS, các cannabinoid tổng hợp thường được nhắm mục tiêu thông qua khối lượng của chúng, được tạo ra dựa trên công thức hóa học của thuốc. Công thức hóa học của một loại thuốc có thể được chuyển đổi thành "số khối chính xác – accurate mass" — giá trị số khối có bốn (hoặc nhiều hơn) vị trí thập phân, tính đến khiếm khuyết khối (mass defect). Số khối chính xác là điều mang lại tính hữu ích của HRMS nói chung. Bảng 7 hiển thị danh sách các cannabinoid tổng hợp thường gặp để bao gồm công thức và khối lượng chính xác của chúng.
3. Kết luận
Phân tích mục tiêu các cannabinoid tổng hợp vẫn là một trong những khía cạnh thách thức nhất trong việc phát hiện NPS. Các nhà khoa học và các phòng thí nghiệm phải luôn nhận thức được những thách thức liên quan đến loại thử nghiệm này và phải chuẩn bị để phát triển các cách để khắc phục chúng. Khi phát triển một phương pháp cho các cannabinoid tổng hợp, trước tiên phải xác định phạm vi phân tích của mình, tức là những cannabinoid tổng hợp nào bạn đang thử nghiệm. Điều này bao gồm sự khác biệt giữa thuốc gốc và chất chuyển hóa; tuy nhiên, đôi khi câu hỏi đó được đặt ra sau khi xác định loại nền mẫu. Khi phát triển bất kỳ phương pháp độc chất học nào, người ta phải xác định nền mẫu nào sẽ được đánh giá. Nói chung, nhà khoa học sẽ chọn nền mẫu chính mà họ quan tâm (ví dụ: máu) và sau đó xác định xem có cần thêm nền mẫu bổ sung hoặc thứ cấp (ví dụ: nước tiểu, mô) hay không. Như chúng ta có thể hiểu từ chương này, đây là nơi quyết định về thuốc gốc và/hoặc/so với các chất chuyển hóa có thể phát huy tác dụng (nên bao gồm đánh giá về tính ổn định). Sau khi phạm vi phân tích được thiết lập và nền mẫu được chọn, bước tiếp theo là xác định nền tảng phân tích. Như đã đề cập, đây thường là LC-MS/MS (hay LC-QQQ-MS). Một bước bổ sung cần xem xét là nồng độ dự kiến của các cannabinoid tổng hợp (và các chất chuyển hóa của chúng) được đề cập, mặc dù thông tin có thể hoặc không có sẵn tùy thuộc vào tính mới lạ của chính loại thuốc.
Một cân nhắc bổ sung cần được khám phá là nhu cầu cập nhật trong tương lai đối với phương pháp đã phát triển. Chúng ta biết rằng NPS cụ thể không phải là tồn tại vĩnh viễn, thường đến và đi trong khoảng thời gian chỉ khoảng một năm. Khi các phòng thí nghiệm phát triển các phương pháp nên xem xét liệu phương pháp này có thể hoặc sẽ cần được cập nhật và/hoặc mở rộng trong tương lai hay không. Nói chung, quá trình mở rộng phương pháp LC-MS/MS cho một chất phân tích mới được quan tâm không quá phức tạp. Sau khi các điều kiện thiết lập máy khối phổ được tối ưu, một loạt các thí nghiệm đơn giản có thể được hoàn thành để đánh giá tính phù hợp của thuốc cho phương pháp hiện có (ví dụ về các thí nghiệm có thể bao gồm đánh giá về khả năng thu hồi, ảnh hưởng nền mẫu, nhiễu,...). Rất khó để dự đoán tần suất một phương pháp mục tiêu nên được cập nhật đối với các cannabinoid tổng hợp (nó phụ thuộc vào thuốc, lịch trình và khu vực); tuy nhiên, người ta khuyên rằng các phòng thí nghiệm nên đánh giá thị trường thuốc và xem xét cập nhật ít nhất 3 tháng một lần. Nếu không, các phòng thí nghiệm ngày càng có nguy cơ bỏ sót các cannabinoid tổng hợp không nằm trong phạm vi phân tích mục tiêu của họ nhưng lại có mặt trong các trường hợp độc chất học.
Việc triển khai một phương pháp mục tiêu thường sẽ mất từ 1 tháng đến 6 tháng (hoặc lâu hơn), thường phụ thuộc vào chính sách của phòng thí nghiệm. Với cơ sở tài liệu đang phát triển cho các cannabinoid tổng hợp, các phòng thí nghiệm có thể dựa vào thông tin này cho mục đích đẩy nhanh quá trình phát triển phương pháp. Hầu hết các chất mới nổi và đang nổi lên có thể được phát hiện thông qua các phương pháp chiết đã được phát triển trước đây, miễn là đặc tính hóa học của chúng không quá khác biệt. Các phương pháp tách sắc ký đã được phát triển trước đó cũng có thể hữu ích, mặc dù vấn đề luôn nằm ở các đồng phân vị trí và các loại thuốc có cùng, tương tự hoặc khối lượng gần giống nhau. Lộ trình này có thể được kết hợp cùng với các thử nghiệm nhanh trong phòng thí nghiệm để đưa phương pháp vào hoạt động. Việc phát triển phương pháp thường mất vài ngày đến vài tuần để hoàn thành. Việc xác nhận phương pháp thường mất ít nhất 1 tuần để hoàn thành, nếu không muốn nói là lâu hơn. Yếu tố cuối cùng là xử lý tất cả dữ liệu và đánh giá hiệu suất của phương pháp trước khi triển khai với các mẫu thực tế, quá trình này có thể mất từ vài ngày đến vài tuần hoặc vài tháng tùy thuộc vào nhiều yếu tố.
Phân tích mục tiêu các cannabinoid tổng hợp dường như là một cách tiếp cận thông thường để thử nghiệm; tuy nhiên, tư duy đổi mới có thể cho phép các phòng thí nghiệm đi trước các xu hướng thuốc đang thay đổi. Mặc dù thử nghiệm mục tiêu không cho phép nhà phân tích thấy những gì họ không tìm kiếm, việc đưa vào các số khối (suspect mass) hoặc chuyển tiếp (suspect transition) "nghi ngờ" có thể giúp xác định những cannabinoid tổng hợp nào khác có thể tồn tại. Điều này có thể giúp quyết định phòng thí nghiệm có thể muốn dành nhiều thời gian hơn cho việc phát triển hoặc cải tiến trong tương lai. Ví dụ: nếu một phòng thí nghiệm biết một cannabinoid tổng hợp methyl ester tồn tại, họ có thể muốn thêm các thông số thiết lập khối phổ tương tự cho biến thể ethyl ester bằng cách chỉ cần thay đổi số khối ion tiền chất bằng cách thêm 14 amu. Nếu một píc xuất hiện trong kênh khối mới này trong quá trình thử nghiệm, phòng thí nghiệm có thể muốn điều tra sự xuất hiện của một chất tương tự mới trong mẫu cụ thể đó.
Đối với nhiều phòng thí nghiệm, phân tích mục tiêu các cannabinoid tổng hợp (bằng LC-MS/MS, HRMS hoặc thậm chí GC-MS) là một công cụ quan trọng để trả lời các câu hỏi quan trọng dựa trên độc chất học liên quan đến việc sử dụng và tác dụng của thuốc. Việc thử nghiệm thường phức tạp và ít thường xuyên hơn so với các nhóm NPS khác và các cân nhắc đặc biệt thường được khuyến khích. Không ai biết điều gì tiếp theo sẽ xảy ra với các cannabinoid tổng hợp, và vì điều này, các phòng thí nghiệm phải luôn cảnh giác và nhận thức được các thị trường thuốc giải trí và các xu hướng mới nổi của chúng. NPS Discovery [www.npsdiscovery.org], một chương trình tại Trung tâm Nghiên cứu và Giáo dục Khoa học Pháp y (CFSRE), đóng vai trò là một hệ thống cảnh báo sớm quốc tế về thuốc truy cập mở và bao gồm các cơ sở dữ liệu trực tuyến với thông tin phân tích về các NPS đang nổi lên. Chương trình này cho phép các nhà khoa học luôn ở vị trí tiên phong của cả phân tích mục tiêu và không mục tiêu. Một phân tích mục tiêu cho các cannabinoid tổng hợp thường không hiệu quả và lỗi thời trong vòng một hoặc hai năm, và các phương pháp được phát triển cách đây hơn 5 năm có thể bị lãng quên và chắc chắn là không đầy đủ. Tuy nhiên, khoa học đã được công bố vẫn là một bản thiết kế quan trọng cho việc đánh giá tiềm năng trong tương lai các cannabinoid tổng hợp. Tóm lại, nếu bạn nghĩ rằng phân tích mục tiêu của bạn đối với các cannabinoid tổng hợp là đủ tốt, thì có lẽ nó không tốt — hãy tiếp tục suy nghĩ về những cách bạn có thể cải thiện xét nghiệm thông qua mở rộng hoặc tinh chỉnh.
4. Tài liệu tham khảo
1. Mason M (2013) Lethal highs: how CBP's laboratories are protecting America from designer drugs. Frontline Mag 6:11–16
2. Seely KA, Lapoint J, Moran JH, Fattore L (2012) Spice drugs are more than harmless herbal blends: a review of the pharmacology and toxicology of synthetic cannabinoids. Prog Neuro-Psychopharmacol Biol Psychiatry 39:234-243. https://doi.org/10.1016/j.pnpbp.2012.04.017
3. EMCDDA home page | www.emcdda.europa.eu. http://www.emcdda.europa.eu/. Truy cập ngày 30 tháng 6 năm 2017
4. National Forensic Laboratory Information System (NFLIS). https://www.deadiversion.usdoj.gov/nflis/
5. NPS Discovery (2019). Cent Forensic Sci Res Educ. https://www.npsdiscovery.org/. Truy cập ngày 11 tháng 1 năm 2019
6. Abbate V, Schwenk M, Presley BC, Uchiyama N (2018) The ongoing challenge of novel psychoactive drugs of abuse. Part I. Synthetic cannabinoids (IUPAC Technical Report). Pure Appl Chem 90:1255–1282. https://doi.org/10.1515/pac-2017-0605
7. Rajasekaran M, Brents LK, Franks LN et al (2013) Human metabolites of synthetic cannabinoids JWH-018 and JWH-073 bind with high affinity and act as potent agonists at cannabinoid type-2 receptors. Toxicol Appl Pharmacol 269:100–108. https://doi.org/10.1016/j.taap.2013.03.012
8. Yeter O, Ozturk YE (2019) Metabolic profiling of synthetic cannabinoid 5F-ADB by human liver microsome incubations and urine samples using high-resolution mass spectrometry. Drug Test Anal. https://doi.org/10.1002/dta.2566
9. Krotulski AJ, Bishop-Freeman SC, Mohr ALA, Logan BK Evaluation of synthetic cannabinoid metabolites in human blood in the absence of parent compounds a stability assessment. J Anal Toxicol. https://doi.org/10.1093/jat/bkaa054
10. Krotulski AJ, Mohr ALA, Logan BK (2020) Emerging synthetic cannabinoids: development and validation of a novel liquid chromatography quadrupole time-of-flight mass spectrometry assay for real-time detection. J Anal Toxicol 44:207-217. https://doi.org/10.1093/jat/bkz084
11. Knittel JL, Holler JM, Chmiel JD et al (2016) Analysis of parent synthetic cannabinoids in blood and urinary metabolites by liquid chromatography tandem mass spectrometry. J Anal Toxicol 40:173-186. https://doi.org/10.1093/jat/bkv137
12. Mogler L, Franz F, Rentsch D et al (2018) Detection of the recently emerged synthetic cannabinoid 5F-MDMB-PICA in 'legal high' products and human urine samples: detection of 5F-MDMB-PICA in herbal blends and human urine. Drug Test Anal 10:196-205. https://doi.org/10.1002/dta.2201
13. Giorgetti A, Mogler L, Halter S et al (2020) Four cases of death involving the novel synthetic cannabinoid 5F-Cumyl-PEGACLONE. Forensic Toxicol 38:314-326. https://doi.org/10.1007/s11419-019-00514-w
14. Tynon M, Homan J, Kacinko S et al (2017) Rapid and sensitive screening and confirmation of thirty-four aminocarbonyl/carboxamide (NACA) and arylindole synthetic cannabinoid drugs in human whole blood. Drug Test Anal 9:924-934. https://doi.org/10.1002/dta.2096
15. Gaunitz F, Kieliba T, Thevis M, Mercer-Chalmers-Bender K (2020) Solid-phase extraction-liquid chromatography-tandem mass spectrometry method for the qualitative analysis of 61 synthetic cannabinoid metabolites in urine. Drug Test Anal 12:27-40. https://doi.org/10.1002/dta.2680
16. Chimalakonda KC, Moran CL, Kennedy PD et al (2011) Solid-phase extraction and quantitative measurement of omega and omega-1 metabolites of JWH-018 and JWH-073 in human urine. Anal Chem 83:6381-6388. https://doi.org/10.1021/ac201377m
17. Kleis J-N, Hess C, Germerott T, Roehrich J Sensitive screening of synthetic cannabinoids using liquid chromatography quadrupole time-of-flight mass spectrometry after solid phase extraction. Drug Test Anal. https://doi.org/10.1002/dta.3052
18. Sobolevsky T, Prasolov I, Rodchenkov G (2012) Detection of urinary metabolites of AM-2201 and UR-144, two novel synthetic cannabinoids. Drug Test Anal 4:745-753. https://doi.org/10.1002/dta.1418
19. Sundström M, Pelander A, Angerer V et al (2013) A high-sensitivity ultra-high performance liquid chromatography/high-resolution time-of-flight mass spectrometry (UHPLC-HR-TOFMS) method for screening synthetic cannabinoids and other drugs of abuse in urine. Anal Bioanal Chem 405:8463–8474. https://doi.org/10.1007/s00216-013-7272-8