
Đang tải...

Đang tải...
Dự đoán in silico, phân tích LC-HRMS/MS, và quy trình khai thác dữ liệu mục tiêu/không mục tiêu để lập hồ sơ các chất chuyển hóa phenylfentanyl in vitro.
Annagiulia Di Trana a, Pietro Brunetti a, Raffaele Giorgetti a, Enrico Marinelli b, Simona Zaami b,Francesco Paolo Busardo` a,*, Jeremy Carlier a,b
a Unit of Forensic Toxicology, Section of Legal Medicine, Department of Excellence of Biomedical Sciences and Public Health, Marche Polytechnic University, 60126,Ancona, Italy
b Unit of Forensic Toxicology, Section of Legal Medicine, Department of Anatomical, Histological, Forensic, and Orthopedic Sciences, Sapienza University of Rome,00198, Rome, Italy
Giới thiệu:
Trong nghiên cứu này nhóm tác giả từ đơn vị pháp y và độc học tại đại học Marche Polytechnic và đại học Sapienza University of Rome đã sử dụng các khối phổ phân giải cao kết hợp các quy trình xử lý số liệu không mục tiêu và có mục tiêu để xác định chất chỉ thị sinh học và các chất chuyển hoá liên quan tới phenylfentanyl một NPS mới. Việc phân tích fentanyl và các chất tương tự fentanyl trong mẫu sinh học thường gặp nhiều khó khăn do liều lượng thấp và quá trình chuyển hóa nhanh chóng. Phenylfentanyl là một chất tương tự fentanyl mới, lần đầu tiên được phát hiện trong các mẫu bị thu giữ vào năm 2017 và hiện tại thông tin về chất này và quá trình chuyển hóa của nó còn rất ít.
Sự chuyển hóa của phenylfentanyl được nghiên cứu bằng cách sử dụng các dự đoán in silico với phần mềm GLORYx, các thí nghiệm ủ sử dụng tế bào gan người, và phân tích sắc ký lỏng kết hợp khối phổ phân giải cao (LC-HRMS/MS). Quy trình phân tích dữ liệu có mục tiêu và không mục tiêu được sử dụng để sàng lọc nhanh và tự-động-một-phần các dữ liệu thô từ LC-HRMS/MS. Khoảng 90.000 chất ban đầu được xác định sau 3 giờ ủ với tế bào gan, và 115 chất đã được chọn tự động để kiểm tra thủ công. Cuối cùng, 13 chất chuyển hóa, chủ yếu được tạo ra bởi quá trình N-dealkyl hóa, thủy phân amide, oxy hóa, và các kết hợp của chúng, đã được xác định. Phenylnorfentanyl được xác định là chất chỉ thị sinh học chính cho việc sử dụng phenylfentanyl. Các chất chuyển hóa chính khác bao gồm N-Phenyl-1-(2-phenylethyl)-4-piperidinamine (4-ANPP), 1-(2-phenylethyl)-4-piperidinol, và các chất chuyển hóa không đặc hiệu khác. Các biến đổi pha II rất hiếm, và việc thủy phân các mẫu sinh học không cần thiết để tăng khả năng phát hiện các chất chuyển hóa không liên hợp. Quy trình tổng thể này dễ dàng thích ứng cho việc lập hồ sơ chất chuyển hóa của các chất gây nghiện mới khác.
Sau đây là bản tóm tắt lược dịch từ bài báo gốc: “In silico prediction, LC-HRMS/MS analysis, and targeted/untargeted data-mining workflow for the profiling of phenylfentanyl in-vitro metabolites, DOI: 10.1016/j.talanta.2021.122740”. Người dịch, TS. Lê Sĩ Hưng, tốt nghiệp tiến sĩ tại đại học BOKU Vienna (Cộng hoà Áo) ngành hoá phân tích, đã có trên 10 năm kinh nghiệm làm việc với các thiết bị khối phổ, tập trung vào ứng dụng các kỹ thuật khối phổ trong phân tích các chất chuyển hoá (metabolites) và protein trong các đối tượng mẫu sinh học, ORCID: 0000-0002-0762-3492.
1. Mở đầu
Nhóm chất tương tự fentanyl (fentanyl analogues) đã trở thành mối quan ngại lớn đối với sức khỏe cộng đồng do tính chất gây chết người mạnh hơn rất nhiều so với các opioid thông thường, với độc lực cao hơn từ 25 đến 10.000 lần so với morphine. Sự gia tăng các ca tử vong do quá liều opioid tổng hợp, đặc biệt là fentanyl và các chất tương tự, đã gây ra tình trạng khủng hoảng nghiêm trọng tại Hoa Kỳ và châu Âu. Các trường hợp tử vong thường do suy hô hấp, ngừng tim hoặc phản ứng dị ứng nghiêm trọng.
Fentanyl và các chất tương tự đã làm thay đổi đáng kể nhân khẩu học của các ca tử vong do opioid, với hàng ngàn trường hợp tử vong được ghi nhận. Các cơ quan chức năng ở châu Âu cũng báo cáo về 930 vụ thu giữ opioid tổng hợp tại 13 quốc gia, bao gồm cả các tiền chất fentanyl tổng hợp và nhiều ca ngộ độc cấp tính liên quan. Ngoài ra, các con đường tổng hợp mới cho việc sản xuất fentanyl bất hợp pháp đã được phát hiện, với sự xuất hiện của các tạp chất bất thường trong các mẫu bị tịch thu.
Phenylfentanyl, một chất tương tự fentanyl, lần đầu tiên được báo cáo vào năm 2017 tại châu Âu và vào năm 2018 tại Hoa Kỳ. Mặc dù đã có dữ liệu LC-HRMS/MS và NMR về chất này, thông tin về dược động học của nó vẫn còn hạn chế. Việc phát hiện các chất tương tự fentanyl trong mẫu sinh học rất khó khăn do liều hoạt tính thấp và quá trình chuyển hóa nhanh chóng của chúng, làm cho việc nghiên cứu dược động học trở nên cần thiết để xác định các dấu hiệu sinh học của việc tiêu thụ.
Nhiều nghiên cứu về hồ sơ chuyển hóa của các chất NPS (New Psychoactive Substances) đã được thực hiện, bao gồm nuôi cấy tế bào gan người hoặc động vật, cùng với các mô hình in vivo như chuột hoặc ấu trùng cá ngựa vằn, kết hợp với phân tích mẫu sinh học. Tuy nhiên, sự chuyển hóa của các chất tương tự fentanyl rất khó dự đoán, với các yếu tố như kích thước của chuỗi alkyl và cấu trúc của nhóm thay thế cho carbon của nhóm amide đóng vai trò quan trọng.
Sau khi ly tâm mẫu, 100 μL dịch nổi được vortex với 100 μL ACN và ly tâm trong 10 phút ở 15.000 x g, ở nhiệt độ phòng. Dịch nổi sau đó được làm khô hoàn toàn dưới khí N2 ở 37 °C, sau đó còn lại được hòa tan với 150 μL dung dịch pha động A: pha động B (8:2 v/v). Sau khi ly tâm trong 10 phút ở 15.000 g, ở nhiệt độ phòng, phần dung dịch phía trên được chuyển vào lọ HPLC, 10 μL mẫu được bơm lên cột.
Tế bào gan được làm lạnh ở 37°C và trộn nhẹ trong 50 mL dung dịch môi trường rã đông ở cùng nhiệt độ trong ống hình nón polypropylene 50 mL. Ống được ly tâm ở 100 x g trong 5 phút, phần mẫu lắng được rửa bằng 50 mL sWME ở 37°C. Sau khi ly tâm, tế bào được hòa tan lại trong 2 mL dung dịch sWME, khả năng sống của tế bào được đánh giá bằng thử nghiệm trypan blue. Nồng độ tế bào được điều chỉnh thành 2 × 10^6 tế bào sống/mL.
Việc ủ mẫu được chuẩn bị trong đĩa nuôi cấy 24 giếng vô trùng với 250 μL huyền phù tế bào gan ở nồng độ 2 × 10^6 tế bào sống/mL trong sWME và 250 μL phenylfentanyl ở nồng độ 20 μmol/L trong sWME. Các mẫu được đặt trong tủ ủ đã được điều chỉnh ở 37°C và các phản ứng chuyển hóa được dừng lại bằng 500 μL acetonitrile lạnh sau 0 giờ hoặc 3 giờ. Các mẫu sau đó được chuyển vào ống vi mô, ly tâm ở 15,000 g trong 10 phút, và chuẩn bị để phân tích.
Diclofenac cũng được ủ dưới điều kiện tương tự, với việc theo dõi 4′-hydroxydiclofenac và diclofenac acyl-β-D-glucuronide để đảm bảo hoạt động chuyển hóa chính xác. Ngoài ra, các mẫu âm tính là tế bào gan trong sWME không có phenylfentanyl và phenylfentanyl trong sWME không có tế bào gan – được chuẩn bị để đánh giá các phản ứng tự phát.
Quá trình tách sắc ký được thực hiện trên cột Kinetex Biphenyl (150 x 2,1 mm, 2 μm) từ Phenomenex, với gradient pha động A gồm 0,1 % FA trong nước (MPA) và pha động B gồm 0,1 % FA trong ACN (MPB). Tốc độ dòng 0,4 mL/phút. Gradient bắt đầu với 5% MPB giữ trong 2 phút, tăng lên 40% MPB trong 18 phút, tăng lên 95% MPB trong 2 phút, và giữ trong 5 phút trước khi trở lại điều kiện ban đầu trong 0,1 phút, tiếp theo là 2,9 phút cân bằng; tổng thời gian chạy là 30 phút. Nhiệt độ bộ lấy mẫu tự động là 10 ± 1 °C và nhiệt độ cột là 37 ± 1 °C.
Mẫu được tiêm hai lần, ở chế độ ion dương và ion âm, sử dụng cùng một nguồn ion hóa và cài đặt MS. Khoảng quét phổ MS: 80 – 750 m/z. Tối đa: 5 phổ MS/MS được tự động kích hoạt để ghi tín hiệu cho mỗi phổ MS tùy thuộc vào danh sách bao gồm các chất chuyển hóa tiềm năng dựa trên các dự đoán in silico và chuyển hóa của các chất tương tự phenylfentanyl; các ion khác không có trong danh sách ưu tiên cũng có thể kích hoạt việc ghi phổ MS/MS; ngưỡng cường độ để kích hoạt ghi phổ MS/MS là 10⁴. Ngoài ra, các giá trị m/z trong nền mẫu với cường độ cao được xác định bằng cách bơm một mẫu trắng (MPA, 8:2 v/v) với cùng các điều kiện phân tích, sau đó được thêm vào danh sách loại trừ ở cả 2 chế độ ion hoá âm và dương.
Các chất chuyển hóa dự kiến của phenylfentanyl được dự đoán bằng cách sử dụng phần mềm miễn phí GLORYx trực tuyến, New E-Resource for Drug Discovery (NERDD). GLORYx cho phép dự đoán và xếp hạng các chất chuyển hóa pha I và pha II thông qua tích hợp dự đoán các vị trí phản ứng dựa trên học máy để thiết lập quy tắc phản ứng.
Danh sách chất chuyển hóa được tạo ra bằng cách sử dụng chuỗi SMILES của phenylfentanyl và các tùy chọn "chuyển hóa pha I và pha II". Các chất chuyển hóa có điểm số cao hơn 0,30 được chọn và xử lý lại để mô phỏng phản ứng chuyển hóa bước thứ hai; điểm số chất chuyển hóa thế hệ thứ hai được nhân với điểm số chất chuyển hóa thế hệ thứ nhất và các điểm số cuối cùng cao hơn 0,18 được xem xét.
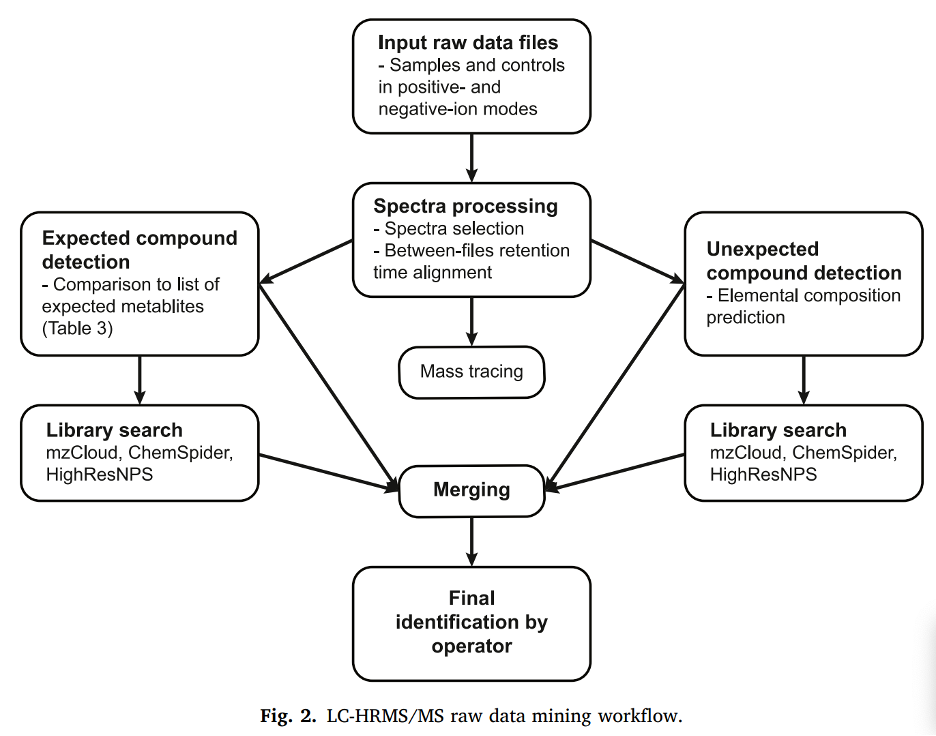
Dữ liệu thô từ các mẫu và mẫu đối chứng được xử lý đồng thời. Tất cả các phổ được chọn và thời gian lưu của các píc sắc ký tương đối được căn chỉnh giữa các file kết quả để dễ dàng so sánh, theo mô hình adaptive curve, với độ lệch tối đa 0,1 phút và toelrance (dung sai) về số khối là 5 ppm. Các phổ thu được từ tất cả các mẫu được align (là thao tác phần mềm tự động trồng các phổ từ các mẫu lên nhau và tìm các chất cùng hiện diện trong mẫu/tất cả các mẫu theo 1 quy tắc cụ thể) sau đó được xử lý theo phương pháp xử lý số liệu không mục tiêu (non-targeted) và có mục tiêu (targeted).
Các píc sắc ký có cường độ cao hơn 10⁶, tỷ lệ tín hiệu/nhiễu cao hơn 3, và tolerance về cường độ tín hiệu 30 % đối với đồng vị được chọn; các píc có ít hơn 3 lần quét (3 điểm ghi dữ liệu) hoặc độ rộng píc lớn hơn 0,5 phút đều bị loại trừ. Khi có thể, adduct [M+H]+, [M+Na]+, [M+K]+, [M+NH4]+, [M+H–H2O]+, [M− H]-, [M+Cl]-, và [M+HCOOH]- được nhóm lại (với tolerance về số khối là 5 ppm) và adduct [M+H]+ được sử dụng làm ion cơ bản. Các hợp chất không xác định được nhóm lại giữa các file kết quả với tolerance về số khối là 5 ppm và tolerance về thời gian lưu là 0,1 phút, và thành phần nguyên tố của chúng được dự đoán trong phạm vi C7H6 đến C36H50N5O12S2.
Các phổ MS/MS và công thức phân tử được so sánh với các thư viện đã chọn: mzCloud (cơ sở dữ liệu về ma túy bất hợp pháp), ChemSpider (cơ sở dữ liệu Cayman Chemical và DrugBank) và HighResNPS. mzCloud là cơ sở dữ liệu chứa phổ khối lượng và phổ ion sản phẩm ở các năng lượng va chạm khác nhau của khoảng 20.000 hợp chất trong các lĩnh vực khoa học đời sống, chuyển hóa học, nghiên cứu dược phẩm, độc học, điều tra pháp y, phân tích môi trường, kiểm soát thực phẩm và ứng dụng công nghiệp. ChemSpider là cơ sở dữ liệu chứa thông tin về hơn 100 triệu hóa chất từ hơn 270 nguồn dữ liệu. HighResNPS là cơ sở dữ liệu HRMS được chia sẻ bởi cộng đồng, chứa phổ khối lượng của các chất NPS với hơn 5200 mục, trong đó có 2100 mục là duy nhất.
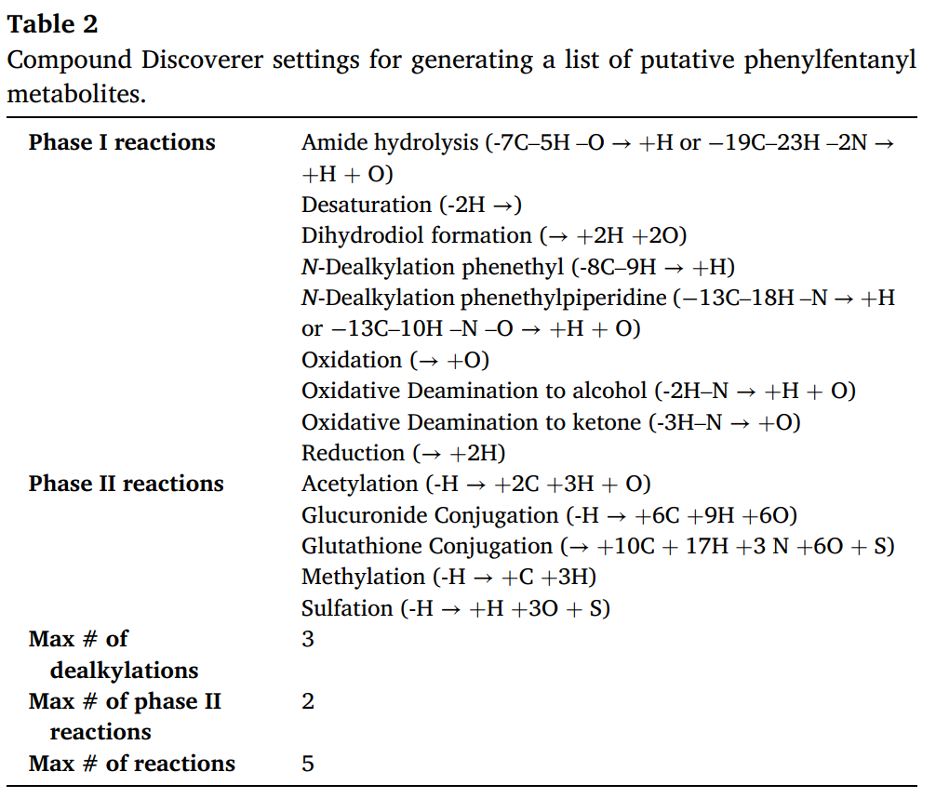
Một danh sách các chất chuyển hóa theo lý thuyết được tạo ra bằng cách kết hợp các biến đổi chuyển hóa pha I và pha II có khả năng xảy ra, theo các cài đặt được hiển thị trong Bảng 2. Các píc sắc ký có cường độ cao hơn 5 × 10³, tỷ lệ tín hiệu/nhiễu cao hơn 3 và tolerance về cường độ tín hiệu là 30% đối với đồng vị được so sánh với danh sách các hợp chất dự kiến với với tolerance về số khối là 5 ppm. Các hợp chất được nhóm lại giữa các file dữ liệu với tolerance về thời gian lưu là 0,1 phút và so sánh với các thư viện mzCloud, ChemSpider và HighResNPS.
Kết quả từ các phương pháp xử lý dữ liệu không mục tiêu và có mục tiêu được gộp lại, và các hợp chất phát hiện trong mẫu đối chứng với cường độ tương tự hoặc cao hơn so với những hợp chất được phát hiện trong quá trình ủ phenylfentanyl được lọc ra. Cuối cùng, kết quả được kiểm tra thủ công để định danh và xác nhận cấu trúc.
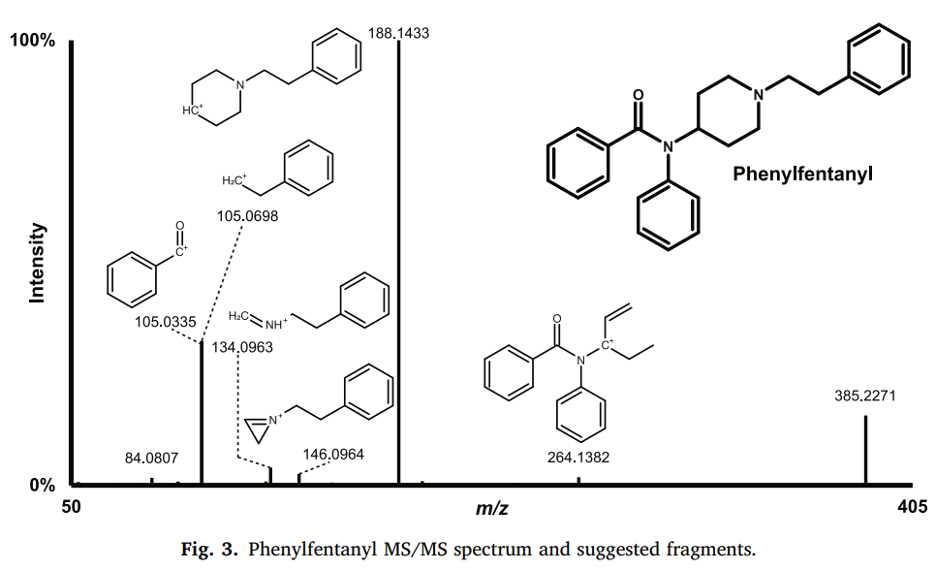
Nhiệt độ của cappilary (ống mao quản chuyển ion trong 1 số thiệt bị MS) được giữ thấp nhất theo khuyến cáo để hạn chế sự phân mảnh của chất trong nguồn ion hoá (in-source fragmentation) của các chất chuyển hóa, điều thường được quan sát thấy với các liên hợp glucuronide. Mô hình phân mảnh của phenylfentanyl tương thích với tài liệu, với ion m/z 188,1433 được tạo ra bởi nhóm phenthylpiperidine của phân tử và là mảnh có tín hiệu mạnh nhất. Sự phân mảnh tiếp theo tạo ra các ion m/z 134,0963 và 146,0963 do sự cắt đứt vòng piperidine, và ion m/z 105,0698 được tạo ra bởi nhóm phenethyl. Ion m/z 105,0335 cũng có tín hiệu cao và được tạo ra bởi nhóm benzaldehyde của phenylfentanyl, đây là những mảnh quan trọng cho việc làm rõ cấu trúc của nhiều chất chuyển hóa phenylfentanyl. Ion m/z 264,1383 chỉ cho tín hiệu tương đối thấp.
Quy trình phân tích không mục tiêu, phát hiện được 7103 và 3215 hợp chất trong mẫu gan được ủ 3 giờ với phenylfentanyl ở các chế độ ion hoá dương và âm tương ứng. Phân tích có mục tiêu, chỉ ra danh sách 30.049 kết hợp lý thuyết của các biến đổi chuyển hóa đã được tạo ra, cho phép phát hiện 11.683 và 7912 hợp chất trong quá trình ủ 3 giờ ở các chế độ ion dương và ion âm tương ứng. Tổng cộng 89.469 hợp chất đã được phát hiện trong tất cả file kết quả sau khi hợp nhất kết quả (các mẫu đối chứng và mẫu ủ ở cả 2 chế độ ion hoá), bao gồm các chất chuyển hóa phenylfentanyl, các thành phần từ nền mẫu và các tạp chất. Các hợp chất tới từ nền mẫu và các chất không gây ra bởi enzyme được loại bỏ bằng cách sử dụng mẫu đối chứng. Các hợp chất có diện tích píc sắc ký nhỏ hơn 0,5% so với chất chuyển hóa của phenylfentanyl có tín hiệu mạnh nhất trong trong mẫu gan ủ 3 giờ (3,9 × 10⁷) cũng đã được loại khỏi danh sách quan tâm. Danh sách các chất quan tâm cuối cùng được giảm xuống còn 115 chất chuyển hóa tiềm năng của phenylfentanyl, được kiểm tra thủ công. Quy trình xử lý số liệu có mục tiêu/không mục tiêu được áp dụng trong nghiên cứu này đảm bảo rằng bất kỳ hợp chất nào liên quan đến phenylfentanyl, thậm chí là các chất chuyển hóa được tạo ra thông qua các phản ứng không mong đợi, đều có thể được xác định.
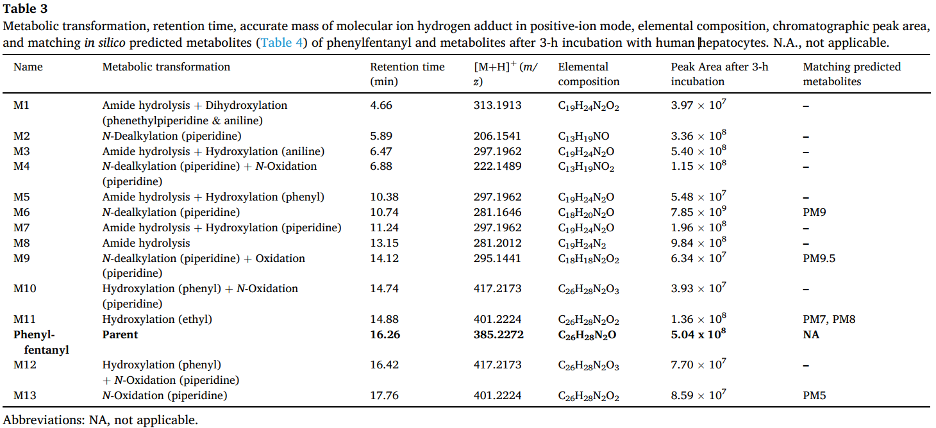
Phenylfentanyl không được phát hiện ở chế độ ion hoá âm, nhưng đã được xác định tự động ở chế độ ion hoá dương ở cả 2 quy trình các phân tích có mục tiêu và không mục tiêu (sử dụng thư viện mzCloud và HigResNPS). Diện tích píc của phenylfentanyl trong mẫu tế bào gan ủ 0 giờ là 1,74 × 1010, phù hợp với các mẫu ủ mà không có tế bào gan và cao hơn khoảng 35 lần so với mẫu tế bào gan ủ 3 giờ. 13 chất chuyển hóa đã được xác định và liệt kê từ M1 đến M13 với thời gian lưu tăng dần. Kết quả và phổ đã được báo cáo lên cơ sở dữ liệu mzCloud và HighResNPS để bổ sung vào thư viện có sẵn cho mục đích sàng lọc.
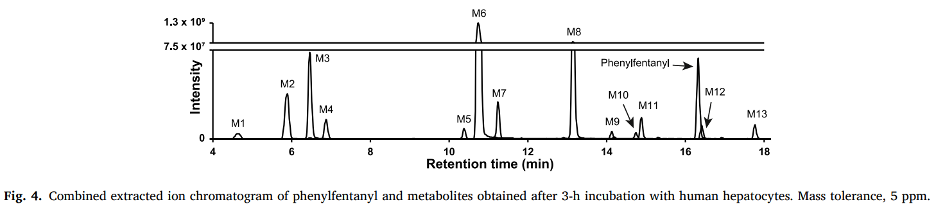
Các biến đổi chuyển hóa chính trong pha I bao gồm N-dealkylation tại nhóm piperidine (các chất M2, M4, M6, và M9), thủy phân amide (M1, M3, M5, M7, và M8), hydroxyl hóa tại aniline (M1 và M3) và nhóm phenethylpiperidine (M1, M5, M7, M10, M11, và M12), N-oxidation của vòng piperidine (M4, M10, M12, và M13). Phản ứng lactam là một phản ứng nhỏ trong pha I (M9). Mặc dù các liên hợp glucuronide và sulfate đã được báo cáo trong quá trình chuyển hóa các chất tương tự fentanyl in vitro và in vivo, các phản ứng pha II của phenylfentanyl hiếm gặp và có cường độ dưới ngưỡng đã thiết lập trong nghiên cứu này.
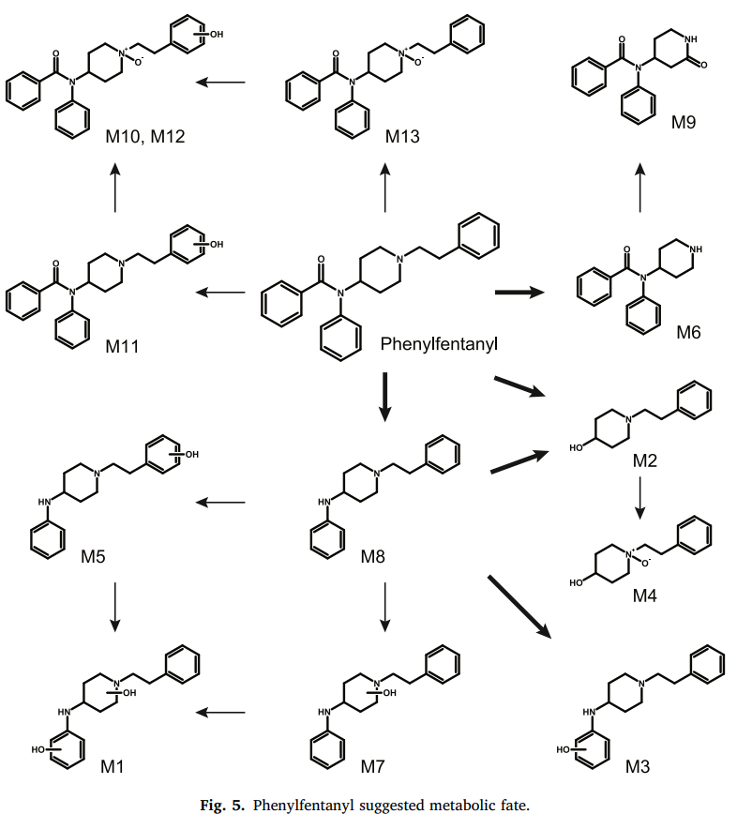
M8 rửa giải ở 13,15 phút và được tạo ra thông qua sự thủy phân của nhóm amide phenylfentanyl (–7C–4H–O), với sự thay đổi khối lượng −104,0260 Da từ chất gốc. Mô hình phân mảnh của M8 chứa các mảnh phenylfentanyl chính (m/z 188,1432, 105,0698, 134,0963 và 146,0963) với cường độ tương đối tương tự, nhưng không chứa m/z 105,0335 (được tạo ra bởi nhóm benzaldehyde của phenylfentanyl), xác định tin cậy công thức cấu tạo của M8. Hơn nữa, M8 được định danh tự động bởi các thư viện mzCloud, Chemspider, và HighResNPS sử dụng số khối chính xác, thành phần nguyên tố, và mô hình phân mảnh tương ứng. Chất chuẩn 4-ANPP (1 μg/mL) được sử dụng để định danh ở cấp độ 1, được phân tích ở cùng điều kiện LC-HRMS để xác nhận chất chuyển hóa: thời gian lưu và mô hình phân mảnh khớp với M8.
M6 rửa giải ở 10,73 phút, [M+H]+ có khối lượng chính xác m/z 281,1646, phù hợp với thành phần nguyên tố của phenyl norfentanyl, được tạo ra bởi N-dealkylation của vòng piperidine phenylfentanyl (–8C–8H). Sự cắt α tại nhóm amide tạo ra các ion m/z 198,0913 và m/z 84,0808, mảnh có tín hiệu mạnh nhất, khớp với mảnh phenethylpiperidine sau N-Dealkylation. Mảnh m/z 105,0334, cũng được quan sát trong mô hình phân mảnh của phenylfentanyl, được tạo ra bởi nhóm benzaldehyde của chất chuyển hóa. Việc không có mảnh m/z 105,0699 thể hiện phần phenethyl bị mất.
M6 là chất chuyển hóa có tín hiệu mạnh nhất trong mẫu tế bào gan ủ 3 giờ, với diện tích píc sắc ký là 7,85 × 10⁹. Phản ứng này được trung gian bởi CYP3A4 và CYP3A5 trong quá trình chuyển hóa fentanyl và các chất tương tự.
Trong quá trình oxy hóa của phenylfentanyl, hai chất chuyển hóa được tạo ra với sự gia tăng khối lượng (+O), cụ thể là M11 và M13. M11 có một mô hình phân mảnh đặc trưng bởi sự mất nước thể hiện sự oxy hóa xảy ra tại chuỗi ethyl của nhóm phenethylpiperidine. Trong khi đó, M13 cho thấy sự oxy hóa tại vòng piperidine (mảnh m/z 105,0698 chỉ ra sự có sự thay đổi piperidine).
Các chất chuyển hóa bị thủy phân amide và oxy hóa cũng được phát hiện, gồm M3, M5 và M7. Trong số đó, M1 cho thấy một sự kết hợp của thủy phân amide và di-oxy hóa, nhưng xuất hiện với cường độ thấp.
Một quá trình N-dealkylation bổ sung tạo ra M9, được oxy hóa tại vòng piperidine. M10 và M12 là các chất chuyển hóa dihydroxyl hóa, với sự oxy hóa xảy ra tại chuỗi phenethylpiperidine và vòng piperidine. Các chất chuyển hóa này có thời gian rửa giải muộn, cho thấy sự N-oxy hóa.
Ba chất chuyển hóa của hydroxy-4-ANPP (M3, M5 và M7) được tạo ra qua quá trình thủy phân amide (–7C–4H–O) và hydroxyl hóa (+O) sau 3 giờ ủ với tế bào gan người, với sự thay đổi khối 88,0310 Da so với chất gốc. M3, M5 và M7 rửa giải ở các thời gian 6,46, 10,38 và 11,24 phút. M3 có mô hình phân mảnh gần giống với 4-ANPP (M8), chỉ ra quá trình hydroxyl hóa tại vòng phenyl của nhóm aniline. Ngược lại, các phân mảnh của M5 và M7 chỉ ra sự hydroxyl hóa có thể diễn ra tại chuỗi phenethyl hoặc vòng piperidine.
M6 là chất chuyển hóa phenylfentanyl có cường độ cao nhất, trong khi M9 (rửa giải tại 14,12 phút) được tạo ra bởi quá trình N-dealkyl hóa và oxy hóa tại vòng piperidine. Mô hình phân mảnh của M9 xác nhận quá trình oxy hóa tại vòng piperidine, có khả năng dẫn đến sự hình thành lactam.
M10 và M12, rửa giải tại 14,74 và 16,42 phút, được tạo ra sau quá trình dihydroxyl hóa phenylfentanyl. Các mảnh m/z 220,1326 và m/z 202,1227 cho thấy phản ứng oxy hóa tại chuỗi phenethylpiperidine. Cả hai chất chuyển hóa có thể trải qua quá trình N-oxy hóa, với sự hydroxyl hóa tại vòng piperidine và nhóm phenyl của chuỗi phenethyl.
Mặc dù các phản ứng chuyển hóa trong nhóm NPS của các dẫn xuất fentanyl có thể được dự đoán, quá trình chuyển hóa của các chất này vẫn khó để xác định. Phần mềm GLORYx không thể dự đoán chính xác các chất chuyển hóa của phenylfentanyl, do quá trình thủy phân nhóm amide không được tính đến. Do đó, nghiên cứu chuyển hóa in vitro vẫn là bước quan trọng đầu tiên để tiến hành các nghiên cứu chuyển hóa in vivo.
13 chất chuyển hóa của phenylfentanyl được xác định, chủ yếu liên quan tới các quá trình N-dealkyl hóa, thủy phân amide và oxy hóa. Phenylnorfentanyl (M6) được đề xuất là chỉ thị sinh học (biomarker) chính của phenylfentanyl, và mô hình phân mảnh của chất được đề xuất để thêm vào các thư viện trực tuyến như mzCloud và HighResNPS. Một số chất chuyển hóa khác, như 4-ANPP (M8) và 1-(2-phenylethyl)-4-piperidinol (M2), không đặc hiệu cho phenylfentanyl và do đó có thể gây cản trở tới việc xác định dương tính chất khi không sử dụng đúng chỉ thị xinh học đặc hiệu.