Phương pháp phân tích các chất hướng thần mới trong dược học và độc học - Chương 2
Methods for Novel Psychoactive Substance Analysis, Methods in Pharmacology and Toxicology
Biên soạn bởi
Marta Concheiro
Department of Sciences, John Jay College of Criminal Justice, City University of New York,
New York, NY, USA
Karl B. Scheidweiler
Scientific Affairs, Toxicology R&D, Abbot/Immunalysis, Pomona, CA, USA
Chương 2: Phân tích Mục tiêu các Cathinone Tổng hợp trong Máu và Nước tiểu
Tác giả: Elena Lendoiro và Ana de-Castro-Ríos
Lời giới thiệu: Sau đây là bản tóm tắt lược dịch chương 2 từ cuốn sách: “Methods for Novel Psychoactive Substance Analysis, Methods in Pharmacology and Toxicology, của các biên tập Marta Concheiro và Karl B. Scheidweiler; DOI: https://doi.org/10.1007/978-1-0716-2605-4_2”. Người dịch, TS. Lê Sĩ Hưng, tốt nghiệp tiến sĩ tại đại học BOKU Vienna (Cộng hoà Áo) ngành hoá phân tích, đã có trên 10 năm kinh nghiệm làm việc với các thiết bị khối phổ, tập trung vào ứng dụng các kỹ thuật khối phổ trong phân tích các chất chuyển hoá (metabolites) và protein trong các đối tượng mẫu sinh học, ORCID: 0000-0002-0762-3492. Chương 2 của cuốn sách này tập trung vào phân tích mục tiêu các cathinone tổng hợp trong máu và nước tiểu, những chất hướng thần mới hoạt động như chất kích thích hệ thần kinh trung ương. Chương này mô tả các phương pháp phân tích phổ biến, bao gồm làm sạch mẫu bằng kết tủa protein, chiết lỏng-lỏng và chiết pha rắn, cùng với phân tích bằng các thiết bị như LC-MS/MS và GC-MS. Các thách thức phân tích như xác định chất đối quang và độ ổn định của cathinone trong các điều kiện khác nhau cũng được thảo luận. Nghiên cứu cũng đề cập đến phạm vi nồng độ các chất này trong máu ở các trường hợp lâm sàng và pháp y thực tế.
Tóm tắt
Các cathinone tổng hợp là các chất hướng thần mới, hoạt động như chất kích thích hệ thần kinh trung ương với hoạt tính giao cảm hỗn hợp. Trong những thập kỷ gần đây, chúng đã xâm nhập vào thị trường ma túy như một chất thay thế cho các loại ma túy truyền thống và làm phát sinh sự cần thiết phải phát triển các phương pháp phân tích để xác định chúng trong các mẫu sinh học khác nhau. Máu và nước tiểu là hai nền sinh học chính trong độc chất học lâm sàng và pháp y để kiểm tra và đánh giá việc sử dụng ma túy. Do đó, các phương pháp phân tích phổ biến nhất để phân tích mục tiêu các cathinone tổng hợp trong máu và nước tiểu được mô tả, bao gồm các phương pháp làm sạch để tinh chế và cô đặc chất phân tích (kết tủa protein, chiết lỏng-lỏng và chiết pha rắn) và phân tích bằng dụng cụ để xác định và định lượng (LC-MS/MS và GC-MS). Hơn nữa, các thách thức phân tích như xác định các chất đối quang và các vấn đề về độ ổn định trong quá trình vận chuyển, bảo quản, xử lý và các điều kiện phân tích cũng được thảo luận. Cuối cùng, tổng quan về nồng độ các chất này trong máu được tìm thấy trong các trường hợp lâm sàng và pháp y thực tế cũng được đề cập.
Từ khóa: Cathinone tổng hợp, Máu, Nước tiểu, LC-MS/MS, GC-MS, Chiết lỏng-lỏng, Chiết pha rắn
1. Giới thiệu
Các cathinone tổng hợp là nhóm lớn thứ hai trong các chất hướng thần mới (NPS) được giám sát bởi Trung tâm Giám sát Ma túy và Nghiện ma túy Châu Âu (EMCDDA) và Văn phòng Liên Hợp Quốc về Ma túy và Tội phạm (UNODC) [1, 2]. Các cathinone tổng hợp là các thuốc cường giao cảm có liên quan về mặt hóa học đến cathinone, một alkaloid tự nhiên có trong lá của cây Catha edulis (Khat). Khat mọc ở khu vực Đông Bắc Phi và Bán đảo Ả Rập [3], nơi lá cây này theo truyền thống được nhai để tạo cảm giác hưng phấn và kích thích [4]. Cấu trúc của cathinone, giống như amphetamine, bao gồm một chuỗi tuyến tính ba carbon với một nhóm phenyl gắn vào carbon đầu tiên và một nhóm amino gắn vào carbon thứ hai, nhưng ở cathinone, có thêm một nhóm carbonyl tại carbon β (Hình 1). Sự biến đổi này làm tăng tính phân cực của phân tử và làm giảm khả năng vượt qua hàng rào máu não và do đó, làm giảm hiệu lực của nó [5, 6]. Cathinone hoạt động như một chất kích thích hệ thần kinh trung ương (central nervous system stimulant) với hoạt tính giao cảm hỗn hợp (mixed sympathomimetic activity) [5].
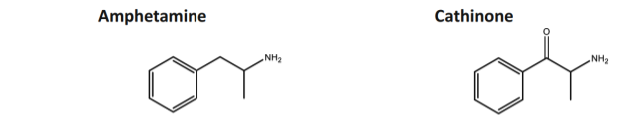
Hình 1: Cấu trúc hóa học của amphetamine và cathinone
Nhiều dẫn xuất cathinone có thể được tổng hợp bằng cách thêm các chất thay thế khác nhau vào bộ khung cốt lõi của phân tử cathinone, chẳng hạn như carbon α, N-cuối và/hoặc vòng thơm [7, 8] (Hình 2). Điều này tạo điều kiện cho việc xâm nhập các cathinone tổng hợp mới vào thị trường ma túy, hiện tại 138 cathinone tổng hợp đang được EMCDDA giám sát [1]. Một số dẫn xuất đã không được tổng hợp gần đây (ví dụ: mephedrone được phát triển vào năm 1929, MDPV vào năm 1969 và α-pyrrolidinohexiophenone (α-PHP) và α-pyrrolidinopentiophenone (α-PVP) vào những năm 1960 [5, 9]), nhưng chúng mới được đưa vào thị trường ma túy giải trí gần [1] như một chất thay thế cho các loại ma túy truyền thống có cấu trúc và tác dụng tương tự như cocaine và amphetamine [10]. Một số cathinone tổng hợp đã được xem xét là các ứng viên thuốc điều trị cho nhiều bệnh khác nhau, nhưng ngày nay, chỉ có bupropion được phép sử dụng trong y tế (thuốc chống trầm cảm và hỗ trợ cai thuốc lá) ở Hoa Kỳ và Châu Âu [11, 12].
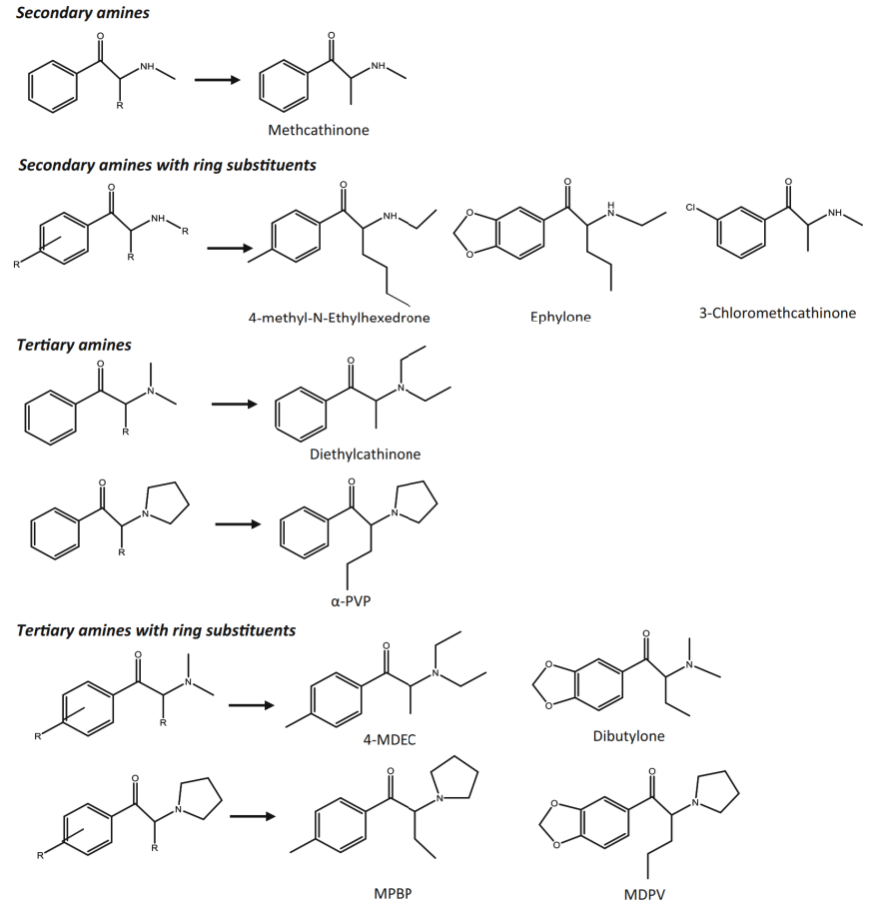
Hình 2: Cấu trúc hóa học của các dẫn xuất cathinone tổng hợp, bao gồm các chất thay thế phổ biến nhất và các ví dụ của mỗi nhóm
Việc sử dụng các cathinone tổng hợp tạo ra các tác dụng kích thích (stimulating effect), hưng phấn (euphoric effect) và đồng cảm (empathogenic effect) nhưng cũng có các tác dụng phụ nghiêm trọng khác như giãn đồng tử (mydriasis), nhịp tim nhanh (tachycardia), tăng huyết áp (hypertension), sốt cao (hyperthermia), co giật (seizures), tiêu cơ vân (rhabdomyolysis), suy thận (renal failure) và suy gan (hepatic failure), thậm chí tử vong [5, 13]. Hơn nữa, các tác dụng phụ về tâm lý như kích động (agitation), ảo giác (hallucinations), hành vi thất thường và hoang tưởng (erratic and delusional behavior), và loạn thần (psychosis) cũng đã được mô tả [14]. Những tác dụng kích thích này có liên quan đến sự ức chế các chất vận chuyển monoamine (inhibition of the monoamine transporters) và sự gia tăng các chất dẫn truyền thần kinh (neurotransmitters) monoamine (dopamine, serotonin và norepinephrine) trong khe khớp thần kinh (synaptic gap) [5, 15]. Cụ thể, các cathinone tổng hợp có thể được phân loại là các cathinone loại cocaine-MDMA hỗn hợp (ức chế sự hấp thu dopamine và norepinephrine một cách không chọn lọc), cathinone loại methamphetamine (ức chế sự hấp thu và giải phóng catecholamine dopamine), và các cathinone loại pyrovalerone (chặn sự hấp thu chọn lọc của catecholamine nhưng không giải phóng chất nền) [15].
Việc sử dụng các hợp chất này chủ yếu là bằng cách hít, tiêm, hút hoặc uống, và các tác dụng được quan sát thấy từ 30–45 phút đến 1–3 giờ sau khi uống [16, 17]. Tuy nhiên, một số tác dụng phụ có thể kéo dài vài giờ và thậm chí đến vài ngày [16]. Việc sử dụng không chủ ý các chất này đã được mô tả vì chúng thường xuyên xuất hiện dưới dạng chất pha trộn của các loại ma túy bất hợp pháp khác.
Việc phát hiện và định lượng các NPS, và đặc biệt là các cathinone tổng hợp, đặt ra một số thách thức từ quan điểm phân tích, chẳng hạn như số lượng lớn các hợp chất phải được theo dõi, sự xuất hiện liên tục các hợp chất mới trên thị trường ma túy, thông tin phân tích hạn chế về chúng, thiếu các chất chuẩn tham chiếu thương mại và các chất tương tự đã được deuter hóa (Chú thích của người dịch: các chất tương tự được deuteri hoá, thay 1 hoặc nhiều H bằng D, chủ yếu cho mục địch sử dụng như nội chuẩn), số lượng lớn các đồng phân và chất tương tự có liên quan về cấu trúc và thiếu thông tin về hồ sơ trao đổi chất (metabolic profile) của chúng, cùng với những yếu tố khác. Chương này tóm tắt các phương pháp phân tích chính để xác định các cathinone tổng hợp trong máu và nước tiểu, hai nền sinh học chính trong độc chất học lâm sàng và pháp y để kiểm tra và đánh giá việc sử dụng ma túy.
2. Kỹ thuật Phân tích
Các phương pháp phân tích đầu tiên được công bố để xác định cathinone tổng hợp trong máu và/hoặc nước tiểu đã được phát triển cho một hợp chất [4, 18] hoặc một số lượng hạn chế các hợp chất [9, 16, 19–24], chủ yếu là để phân tích các mẫu từ một trường hợp pháp y cụ thể. Mặc dù việc phát triển các phương pháp phân tích một số lượng hạn chế các hợp chất và ứng dụng của chúng trong các trường hợp thực tế vẫn hữu ích [14, 15, 23, 25–34], nhưng cũng có một số phương pháp đã được công bố để xác định đồng thời một số lượng lớn các hợp chất [3, 6, 7, 17, 35–46]. Do sự phát triển nhanh chóng của thị trường NPS và hồ sơ sử dụng đa ma túy (polydrug profile) của nhiều người dùng, các phương pháp phân tích đồng thời nhiều hợp chất trở nên hữu ích hơn trong các phòng thí nghiệm độc chất.
Mặc dù việc định lượng nồng độ thuốc trong nước tiểu có giá trị diễn giải hạn chế (limited interpretative value) so với máu [10], nhưng một số phương pháp định lượng trong nước tiểu đã được công bố [11, 17, 19, 20, 22, 25-27, 33–35, 43, 44, 47–49]. Các nghiên cứu chỉ ra rằng các cathinone tổng hợp được chuyển hóa bởi các biến đổi pha I (phase I transformations) như N-dealkyl hóa, khử, hydroxyl hóa, oxy hóa và de-methylen hóa [35], nhưng nhiều chất chuyển hóa trong số này vẫn chưa được xác định hoặc không có chất chuẩn thương mại. Vì lý do này, hầu hết các phương pháp phân tích trong nước tiểu chỉ bao gồm việc phát hiện thuốc gốc [4, 16, 20, 22, 25-27, 33–35]. Chiến lược này đã được chứng minh là hữu ích cho phân tích thường quy vì các hợp chất này thường được tiêu thụ với liều lượng cao và lượng thuốc gốc có trong mẫu nước tiểu đủ để phát hiện [35, 43].
Đối với phân tích máu, huyết thanh hoặc huyết tương thường được sử dụng trong các trường hợp lâm sàng từ những người còn sống. Nồng độ trong huyết thanh và huyết tương có vẻ tương tự nhau, mặc dù có thể có một số khác biệt do việc sử dụng các chất phụ gia khác nhau trong các ống thu thập huyết tương/máu, gây ra sự khác biệt về độ ổn định của chúng [13]. Tuy nhiên, trong các trường hợp sau khi chết, máu toàn phần là nền mẫu lựa chọn và sự thay đổi nồng độ thuốc tùy thuộc vào vị trí lấy mẫu sẽ phụ thuộc vào các yếu tố khác nhau như tình trạng của cơ thể, mức độ chấn thương, hiện tượng tái phân bố sau khi chết, khoảng thời gian sau khi chết, nhiệt độ môi trường và mức độ phân hủy của cơ thể [50].
Quy trình phân tích có mục tiêu các cathinone tổng hợp trong máu và/hoặc nước tiểu được thực hiện qua hai bước. Đầu tiên, cần làm sạch mẫu bằng cách loại bỏ các chất gây nhiễu có thể ảnh hưởng đến việc phát hiện chất phân tích hoặc hiệu suất của thiết bị, để cô đặc các chất phân tích từ nền sinh học và để chuyển đổi dung môi sang một dung môi tương thích hơn về mặt phân tích. Thứ hai, phân tích bằng thiết bị để xác nhận và định lượng các chất phân tích. Chất lượng của kết quả phụ thuộc vào việc thực hiện chính xác các bước này.
2.1. Làm sạch
Một số kỹ thuật chuẩn bị mẫu đã được mô tả để phân tích mục tiêu các cathinone tổng hợp trong máu và/hoặc nước tiểu, bao gồm kết tủa protein [21, 29, 33, 39, 40], chiết lỏng-lỏng (LLE) [9, 10, 14, 16, 17, 19, 25, 27, 28, 30–32, 41, 46, 51], chiết pha rắn ( SPE) [3, 5, 11, 12, 18, 20, 23, 34, 36–38, 43, 52-56], chiết vi pha rắn bằng chất hấp phụ đóng gói (SPME) [24, 57], chiết pha rắn phân tán (dSPE) [15, 22], chiết lỏng-lỏng hỗ trợ bằng muối (SALLE) [58], polymer in dấu phân tử (molecularly imprinted polymer) [59, 60] hoặc sự kết hợp các kỹ thuật [35]. Việc lựa chọn kỹ thuật làm sạch tối ưu phụ thuộc vào số lượng và tính chất hóa lý của chất phân tích, các yêu cầu phân tích của thiết bị, độ phức tạp của nền sinh học hoặc nhu cầu về thông lượng cao.
Phương pháp xử lý mẫu làm sạch tối thiểu được mô tả để phân tích các mẫu máu là sử dụng dung môi hữu cơ để kết tủa protein (protein precipitation) [21, 29, 33, 39, 40]. Tuy nhiên, vì các mẫu nước tiểu ít phức tạp hơn nên có một số phương pháp phân tích trực tiếp các hợp chất này bằng cách pha loãng và tiêm (dilute and shoot) [8, 42, 45, 61, 62]. Quy trình pha loãng và tiêm có lợi trong ứng dụng thực tế bằng cách giảm thiểu quá trình chuẩn bị mẫu, nhưng sẽ khó để áp dụng để phân tích các mẫu phức tạp hơn hoặc một số lượng lớn các hợp chất. Về cơ bản, một lượng nhỏ nước tiểu (50–200 μL) được pha loãng với hỗn hợp dung môi nước và hữu cơ theo tỷ lệ 1:4–1:20 và ly tâm ở tốc độ cao [8, 42, 45, 61, 62]. Trong một số trường hợp, trước khi tiêm vào thiết bị, phần dung dịch nổi (supernatant) được lọc bằng màng PVDF 0,22 μm [8, 45] để loại bỏ một số chất gây nhiễu. Dung môi pha loãng phải có các đặc tính phù hợp để không gây nhiễu khi phân tích. Quy trình pha loãng và tiêm thường được áp dụng để xác định một số lượng hạn chế các chất phân tích, nhưng có hai phương phân tích đồng thời nhiều chất đã được công bố để xác định các cathinone tổng hợp trong nước tiểu [42, 45] sử dụng quy trình này. Al-Saffar et al. [42] xác định 28 "chất gây nghiện hợp pháp", bao gồm 16 cathinone tổng hợp, bằng cách pha loãng 50 μL nước tiểu theo tỷ lệ 1:5 với axit formic 0,1% trong nước, thu được giới hạn định lượng (LOQ) là 0,5–50 ng/mL tùy thuộc vào chất phân tích, trong khi Fan et al. [45] xác định 73 cathinone tổng hợp và các chất chuyển hóa liên quan ở LOQ 0,5–1 ng/mL bằng cách pha loãng 50 μL nước tiểu theo tỷ lệ 1:20 với 50% methanol trong nước và lọc bằng màng PVDF 0,22 μm.
2.1.1. Kết tủa Protein
Kết tủa protein cho phép biến tính (denaturalization) các protein trong máu bằng cách thêm chất kết tủa, thường là dung môi hữu cơ (Chú thích của người dịch: Các dung môi hữu cơ có thể tương tác với các vùng phân cực và không phân cực của protein, chen vào cấu trúc protein, phá vỡ các liên kết kỵ nước, làm lộ các vùng kỵ nước ra ngoài, làm giảm lớp vỏ hydrat hoá từ đó làm protein mất đi cấu trúc tự nhiên và thay đổi độ tan, dẫn tới các protein tương tác dính vào lẫn nhau và kết tủa). Dung môi hữu cơ phổ biến nhất được sử dụng để phân tích các cathinone tổng hợp là acetonitrile [21, 29, 33, 40]; tuy nhiên, việc sử dụng hỗn hợp acetonitrile và methanol theo tỷ lệ 80:20 (v:v) cũng đã được mô tả [39]. Việc sử dụng dung môi lạnh giúp biến tính protein tốt hơn, và do đó cũng thường được sử dụng [21, 33, 39] (Chú thích của người dịch: nhiệt độ thấp làm tăng cường tương tác kỵ nước giữa protein và dung môi hữu cơ, thêm vào đó làm giảm độ tan của protein vào nước). Sau đó, quá trình ly tâm ở tốc độ cao (>12000 g) được thực hiện để kết tủa protein, và phần dung dịch nổi có thể được phân tích trực tiếp.
Kết tủa protein thường tạo ra một số lượng chất gây nhiễu cao hơn trong quá trình phân tích và ảnh hưởng nền mẫu nghiêm trọng hơn so với các kỹ thuật làm sạch khác. Năm phương pháp đã được công bố sử dụng kết tủa protein để xác định các cathinone tổng hợp trong huyết tương [21, 29, 33, 39, 40] nhưng không có phương pháp nào trong máu toàn phần (một nền phức tạp hơn). Hơn nữa, ba trong số đó được phát triển để phân tích một chất phân tích duy nhất [21, 29, 33], mặc dù hai phương pháp còn lại cho phép xác định đồng thời 16 [39] và 19 [40] cathinone tổng hợp. Trong tất cả các nghiên cứu này, ảnh hưởng nền mẫu được phát hiện là không đáng kể hoặc thấp (<34%). Montesano et al. [39] đã nghiên cứu ảnh hưởng nền mẫu gây ra bởi các dung môi khác nhau và hỗn hợp dung môi (acetonitrile, methanol và acetonitrile/methanol). Tác giả kết luận rằng độ thu hồi tương tự nhau thu được với ba dung môi được thử nghiệm, nhưng bằng cách sử dụng acetonitrile/methanol (80:20, v:v), ảnh hưởng nền sẽ thấp hơn (-17% đến 13%), và bằng cách chọn một hỗn hợp dung môi phù hợp, có thể thu giảm được ảnh hưởng nền mẫu bất chấp sự không đặc hiệu của phương pháp [39].
2.1.2. Chiết lỏng-lỏng
Việc sử dụng chiết lỏng-lỏng (LLE) thường được áp dụng trong phân tích các cathinone tổng hợp trong cả máu [10, 14, 16, 19, 25, 27, 28, 30–32, 41, 46] và nước tiểu [9, 10, 16, 17, 25, 27, 46, 51]. Các chất phân tích được phân lập từ nền sinh học tùy thuộc vào độ hòa tan tương đối của chúng trong hai dung môi không trộn lẫn khác nhau, một dung dịch nước (phân cực) và một dung môi hữu cơ (không phân cực), ở độ pH thích hợp. Việc lựa chọn dung môi hữu cơ dựa trên tính phân cực của nó và dung môi ít phân cực nhất nên được chọn để chiết các chất phân tích quan tâm nhưng tránh chiết các chất gây nhiễu. Một số đặc điểm ưa thích của dung môi hữu cơ là độ hòa tan thấp trong nước, khối lượng riêng thấp hơn nước, độ dễ cháy và độc tính thấp, độ bay hơi vừa phải và trơ.
Các cathinone tổng hợp là các hợp chất bazơ, vì vậy đầu tiên các mẫu được kiềm hóa để đạt được độ pH >9. Các dung dịch đệm khác nhau có thể được sử dụng để kiềm hóa, chẳng hạn như amoniac [31], amoni hydroxit [14, 16], natri hydroxit [17], kali hydroxit [51], amoni axetat [10], dung dịch đệm cacbonat [25, 30, 46], dung dịch đệm borat [19, 41], natri tetraborat [28] và amoni cacbonat [32]. Ngoài ra, các dung môi hữu cơ khác nhau đã được sử dụng, bao gồm butyl clorua [14, 19, 25, 30, 51], tert-butylmethyl ether (MTBE) [17, 28, 46], etyl axetat [31, 32, 41], hoặc hỗn hợp của chúng (MTBE:butyl axetat, 1:1 và diclorometan:butyl clorua, 1:4) [10, 16].
Sau khi khuấy, dung dịch gồm 2 dung môi (binary solution) được ly tâm để tách hai pha và dung môi hữu cơ được thu thập và làm bay hơi đến khô. Dạng bazơ của các cathinone tổng hợp dễ bay hơi, vì vậy để tránh mất các hợp chất trong quá trình bay hơi, một số tác giả đã axit hóa dung môi chiết bằng dung dịch axit clohydric trước khi bay hơi (Chú thích của tác giả: Do HCl sẽ phản ứng và tạo thành dạng muối hydrochloride của các cathinone, một hợp chất ion, khi đó các chất này sẽ ưa nước hơn và giảm bay hơi) [14, 19, 25, 30, 51].
Việc sử dụng kỹ thuật LLE để làm sạch đã được chứng minh là phù hợp nhưng chủ yếu là để xác định đồng thời một số lượng hạn chế các chất phân tích [9, 10, 14, 16, 19, 25, 27, 28, 30–32, 51] do tính chọn lọc thấp của kỹ thuật. Chỉ có ba phương pháp đạt được việc phát hiện nhiều chất phân tích trong máu [41] hoặc nước tiểu [17, 46]. Các nhược điểm khác của kỹ thuật này là việc sử dụng một lượng lớn dung môi, tốn thời gian, ít có khả năng tự động hóa và không thân thiện với môi trường.
2.1.3. Chiết Pha Rắn
Các kỹ thuật chiết pha rắn (SPE) mạnh mẽ hơn các kỹ thuật làm sạch khác. Hơn nữa, độ thu hồi của chất phân tích thường được cải thiện và chúng có thể cung cấp tính chọn lọc cao hơn, giới hạn phát hiện thấp hơn và mẫu chiết sạch hơn [52]. Nhiều quy trình SPE khác nhau đã được mô tả để phân tích các cathinone tổng hợp, tất cả đều sử dụng các chất hấp phụ chế độ hỗn hợp [3, 5, 11, 12, 18, 20, 23, 34-38, 43, 52–55, 61]. Các chất hấp phụ chế độ hỗn hợp hoạt động theo hai cơ chế, pha đảo để giữ lại các hợp chất không phân cực hoặc kỵ nước và trao đổi ion để giữ lại các hợp chất tích điện, loại bỏ các chất gây nhiễu nội sinh bổ sung. Các đặc tính cơ bản của các cathinone tổng hợp làm cho các chất hấp phụ chế độ hỗn hợp với các đặc tính trao đổi cation trở thành các cột SPE phù hợp nhất. Các chất hấp phụ này chứa các nhóm tích điện âm trên bề mặt, tương tác với các chất phân tích tích điện dương thông qua các tương tác ion. Các mẫu phải được cân bằng ban đầu bằng dung dịch đệm axit để đạt được giá trị pH chính xác (khuyến nghị hai đơn vị dưới pKa của chất phân tích). Dung dịch đệm phổ biến nhất được sử dụng để điều hòa các mẫu là dung dịch đệm phosphate 0,1 M ở pH 6 [3, 5, 11, 12, 18, 23, 34–38, 43, 52, 53, 61] hoặc pH 4,4 [54], nhưng các dung dịch axit khác có thể được sử dụng, chẳng hạn như axit axetic 1 M ở pH 5,2 [20] hoặc dung dịch axit formic ở pH 3 [55]. Cũng nên cân bằng các cột SPE với một dung môi axit để tích điện âm cho chất hấp phụ và cải thiện khả năng giữ lại các chất phân tích đã ion hóa. Việc cân bằng các cột thường bao gồm ba bước với methanol, nước và dung môi axit, trong đó dung dịch đệm phosphate 0,1 M ở pH 6 được sử dụng phổ biến nhất [3, 5, 12, 18, 23, 34, 38, 43, 53, 61]. Mặc dù vậy, một số nghiên cứu chỉ cân bằng cột với methanol và nước [11, 20, 52, 54].
Sau khi đưa các mẫu lên các cột SPE, các bước rửa được thực hiện để loại bỏ các chất gây nhiễu. Một quy trình rửa cột chiết pha rắn phổ biến bao gồm nước, axit axetic 0,1 hoặc 1 M và methanol [3, 5, 11, 23, 35, 37, 38, 53, 61]. Cuối cùng, việc rửa giải của các chất phân tích được thực hiện bằng cách sử dụng các dung môi hữu cơ đã kiềm hóa, trong đó hỗn hợp diclorometan/isopropanol/amoni hydroxit (78:20:2, v:v:v) được sử dụng phổ biến nhất [3, 5, 11, 12, 18, 23, 34, 38, 52, 54, 61].
2.1.4. Các Kỹ Thuật Làm Sạch Khác
Việc xác định các cathinone tổng hợp trong mẫu máu và/hoặc nước tiểu có thể được thực hiện bằng các kỹ thuật làm sạch khác. Các biến thể khác nhau của SPE thông thường, bao gồm chiết vi pha rắn, polymer in dấu phân tử (molecularly imprinted polymer - MIP) hoặc chiết pha rắn phân tán (dSPE). Chiết vi pha rắn (SPME) là một kỹ thuật SPE thu nhỏ, giúp giảm việc sử dụng mẫu và thể tích dung môi. Các chất phân tích được chiết từ mẫu bằng cách hấp phụ vào vật liệu hấp phụ phủ trong một sợi [24] hoặc bên trong một ống tiêm [57]. Quy trình phân tích tuân theo các bước tương tự như thực hiện trong SPE, nhưng không giống như SPE truyền thống, vật liệu có thể được tái sử dụng nhiều lần. Kỹ thuật này đã được áp dụng để phát hiện ba cathinone tổng hợp và các loại thuốc gây nghiện cổ điển khác trong máu [57] và năm cathinone tổng hợp trong nước tiểu [24], sử dụng lần lượt 300 μL và 3 μL mẫu.
Trong polymer in dấu phân tử (MIP), chất hấp phụ SPE là một polymer chức năng với các khoang ở cấp độ phân tử (molecular-level cavities) thể hiện liên kết chọn lọc. Sự đồng trùng hợp (copolymerization) của các monome chức năng (functional monomer) và liên kết ngang (cross-linking monomer) được thực hiện khi có mặt một phân tử mục tiêu (khuôn - template). Sau khi loại bỏ khuôn, các khoang ba chiều cứng nhắc bổ sung với ái lực và tính chọn lọc giống kháng thể cho phép chiết chọn lọc cao (complementary rigid threedimensional cavities with antibody-like affinity and selectivity allow a highly drug class selective extraction) đối với chất phân tích mục tiêu và các hợp chất có liên quan chặt chẽ khác [63]. Nhiều cột SPE thương mại có sẵn với công nghệ MIP để chiết các chất phân tích mục tiêu khác nhau, chẳng hạn như chất β-agonists, β-blockers, thuốc chống viêm không steroid, nitrosamin hoặc hydrocacbon thơm đa vòng [59]. Murakami et al. [59] đã sử dụng cột MIP thương mại cho các dẫn xuất amphetamine (amphetamine, methamphetamine và methylenedioxyphenylalkylamine) để xác định 11 cathinone tổng hợp trong máu và nước tiểu. Sau khi điều chỉnh pH của dung dịch mẫu được đưa lên các cột ở pH 6, do pKa khác nhau của các cathinone tổng hợp và các dẫn xuất amphetamine, tác giả thấy độ thu hồi cao hơn và hiệu ứng nền ít hơn cho 11 cathinone tổng hợp so với SPE thông thường trên cả hai loại nền sinh học [59]. Mặt khác, việc tổng hợp các chất hấp phụ MIP tại chỗ có thể làm tăng tính chọn lọc cho các cathinone tổng hợp mục tiêu. Sanchez-Gonzalez et al. [60] đã tổng hợp và mô tả đặc tính của chất hấp phụ MIP để phát hiện mười cathinone tổng hợp trong nước tiểu, mặc dù các khoang trong các hạt MIP được thiết kế để nhận biết các nhóm amin và carbonyl, và do đó, chúng có thể nhận biết hiệu quả các cathinone tổng hợp chưa biết khác và các dẫn xuất amphetamine truyền thống [60].
Một kỹ thuật khác được sử dụng để phân tích các hợp chất này là chiết pha rắn phân tán (dSPE) [15, 22]. Trong dSPE, chất hấp phụ rắn được thêm trực tiếp vào mẫu chất lỏng, trước đó đã được xử lý bằng dung môi hữu cơ. Các chất gây ô nhiễm được hấp phụ vào chất hấp phụ, và các chất phân tích quan tâm có trong dung môi. Chất hấp phụ được tách ra bằng một quá trình cơ học như ly tâm hoặc lọc. Kỹ thuật này đã được sử dụng để xác định α-pyrrolidinohexanophenone (α-PHP) [15] trong máu và 3,4-dimethylmethcathinone (3,4-DMMC) trong máu và nước tiểu [22] bằng cách sử dụng QuEChERS, một thiết bị thương mại cho dSPE.
Cuối cùng, chiết lỏng-lỏng hỗ trợ bằng muối (SALLE) là một kỹ thuật làm sạch khác được sử dụng để chuẩn bị mẫu cathinone tổng hợp [58]. Kỹ thuật này đơn giản như kết tủa protein nhưng tạo ra chất chiết sạch hơn và sử dụng ít dung môi hơn so với LLE thông thường. Kỹ thuật này dựa trên việc bổ sung một dung môi hữu cơ trộn lẫn với nước, thường là acetonitrile và một dung dịch muối cô đặc vào mẫu nước. Sự bão hòa dung dịch nước với muối làm giảm độ hòa tan của các phân tử hữu cơ có trong mẫu và sự di chuyển của chúng vào dung môi hữu cơ. Sau khi trộn và ly tâm, dung môi hữu cơ tạo thành một pha tách biệt phía trên dung dịch nước. Dung môi hữu cơ có thể được phân tích trực tiếp, tránh các bước bay hơi và hoàn nguyên (reconstitute) [63]. Ishii et al. đã chiết 500 μL nước tiểu để phát hiện sáu cathinone tổng hợp trong 90 giây bằng cách sử dụng acetonitrile làm dung môi hữu cơ và natri cacbonat khan làm dung dịch muối [58].
2.2. Phân tích công cụ
Phần lớn các phương pháp phân tích được đề xuất cho phân tích mục tiêu các cathinone tổng hợp trong máu và/hoặc nước tiểu đều dựa trên sắc ký khí (GC) hoặc sắc ký lỏng (LC) kết hợp với khối phổ (MS). Để tách các chất này, chỉ có duy nhất 1 nghiên cứu sử dụng điện di mao quản để phát hiện 12 cathinone tổng hợp trong nước tiểu [55]. Kỹ thuật này tách các ion dựa trên khả năng di động điện di (electrophoretic mobility) của chúng khi sử dụng điện áp, và chủ yếu được phát triển để tách các phân tử tích điện như peptide và axit amin. Khi có mặt các dung dịch đệm axit, các cathinone tổng hợp là các cation và có thể di chuyển; tuy nhiên, việc tách các hợp chất này bằng kỹ thuật này rất khó vì cấu trúc và giá trị pKa của chúng rất giống nhau và độ phân giải không đủ tốt, điều này đòi hỏi phải thêm các chất phụ gia (additive) khác nhau vào pha động để cải thiện độ phân giải. Mặc dù LOQ trong phương pháp của Svidrnoch et al. [55] có thể so sánh được hoặc hơi cao hơn so với các phương pháp GC hoặc LC khác, nhưng thể tích mẫu gấp ba lần cần phải được sử dụng.
Về phát hiện, bên cạnh MS có thể sử dụng máy đo quang phổ UV-VIS, cho phép các chất phân tích được xác định bằng cách đo sự hấp thụ ánh sáng ở các bước sóng khác nhau. Mảng diode quang (PDA), có thể đo toàn bộ dải bước sóng đồng thời, đã được sử dụng để phát hiện 3 cathinone tổng hợp và các loại ma túy khác trong huyết tương [57], 22 cathinone tổng hợp trong máu và nước tiểu [38], và 12 cathinone tổng hợp trong nước tiểu [55], sử dụng giá trị λmax lần lượt là 235 và 260 nm, 270 nm và 210, 214 và 254 nm [38, 55, 57].
2.2.1. Tách Sắc ký
GC là kỹ thuật được sử dụng rộng rãi trong lĩnh vực độc học pháp y và lâm sàng do khả năng ứng dụng của kỹ thuật này với một loạt các hợp chất, mạnh mẽ và tính đặc hiệu. Tuy nhiên, các cathinone tổng hợp có thể bị phân hủy nhiệt trong quá trình phân tích bằng GC và do đó, LC là kỹ thuật tách chính được sử dụng để phân tích [35]. Sự phân hủy nhiệt đã được quan sát bởi một số tác giả [64-69], mặc dù theo Kerrigan et al. [69], việc phân huỷ nhiệt có thể được giảm thiểu bằng cách sử dụng nhiệt độ đầu vào thấp hơn (lower inlet temperature), giảm thiểu thời gian lưu trong “inlet” và bằng cách loại bỏ các vị trí hoạt động (active sites) trong quá trình tách sắc ký khí. Các hợp chất đặc trưng được tạo ra bởi sự phân hủy nhiệt được gọi là imine (từ việc mất một hydro từ nitơ trong nhóm amin) và enamine (từ việc mất một hydro từ liên kết carbon-carbon) [69]. Các sản phẩm phân hủy này có thể khó tách khỏi thuốc gốc của chúng và có nhiều ion đặc trưng giống nhau [35]. Tuy nhiên, các phương pháp GC khác nhau đã được mô tả để xác định các cathinone tổng hợp trong mẫu máu và/hoặc nước tiểu [3–5, 9–11, 14, 17-19, 23, 46, 51–54, 61].
Trong GC, sự tách sắc ký được thực hiện trong một cột chứa một pha tĩnh rắn, trong đó có dòng liên tục của một khí mang trơ (pha động) đi qua sử dụng một gradient nhiệt độ. Cột phổ biến nhất được sử dụng là cột (5%-phenyl)-methylpolysiloxan không phân cực với heli làm khí mang ở tốc độ dòng 0,8–1,8 mL/phút [3, 5, 9–11, 14, 17, 52–54, 61]. Nhiệt độ cổng bơm mẫu dao động từ 200 °C đến 280 °C [3, 5, 10, 11, 14, 17-19, 23, 51–54, 61] và chế độ không chia dòng (splitless) thường được sử dụng trong quá trình tiêm [3, 5, 9–11, 18, 19, 23, 51, 53, 61], mặc dù tỷ lệ chia dòng (split) 1:5–1:16 cũng đã được sử dụng [17, 46, 52, 54].
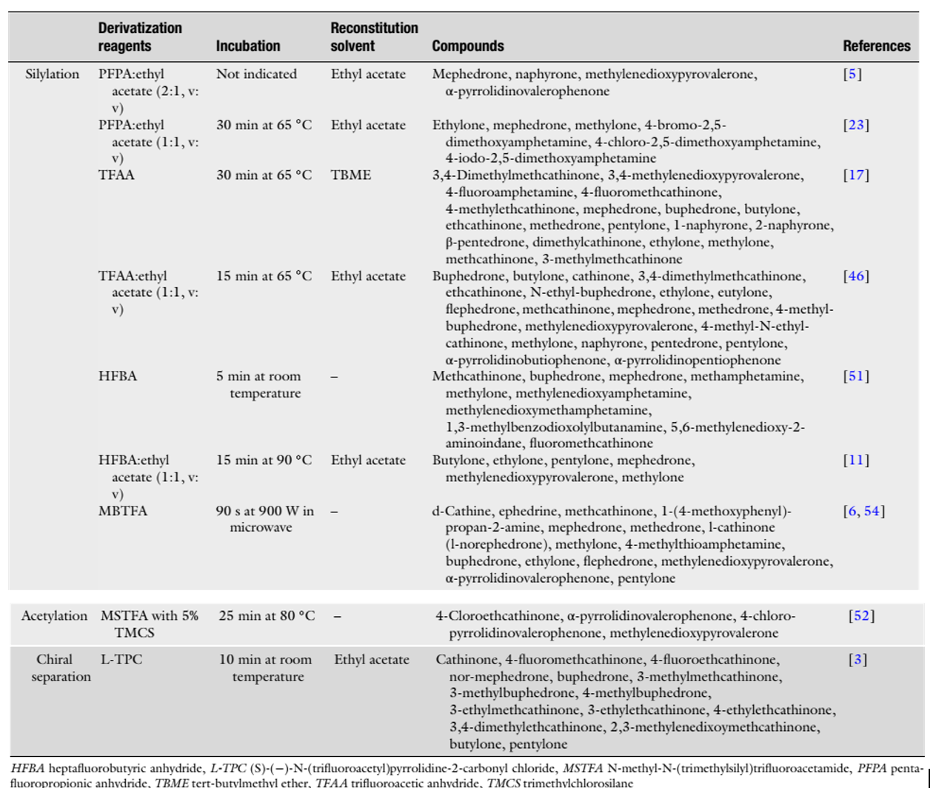
Một nhược điểm chính của GC là cần phải thực hiện các quy trình dẫn xuất hóa, đặc biệt là do điểm sôi thấp và chất lượng phổ khối tương đối kém của nhiều cathinone tổng hợp [69]. Quá trình dẫn xuất hóa tạo điều kiện thuận lợi cho việc tách sắc ký các chất phân tích và tăng khả năng bay hơi, khả năng phát hiện và độ ổn định của chúng, nhưng tốn thời gian và làm tăng chi phí. Đối với các dẫn xuất pyrrolidine, là các amin bậc ba không có hydro hoạt động trong nhóm amin, quá trình dẫn xuất hóa bị ngăn chặn bằng cách sử dụng các phương pháp dẫn xuất hóa thông thường [69]. Alexandridou et al. [10] đã nghiên cứu khả năng sử dụng dẫn xuất hóa cho một số NPS bao gồm ba cathinone tổng hợp (mephedrone, methylone và methylenedioxypyrovalerone hoặc MDPV) bằng cách sử dụng hai thuốc thử silylation (BSTFA với 1% TMCS và MTBSTFA) và ba thuốc thử acetyl hóa (HFBA, TFAA và PFPA). Đối với các hợp chất này, quá trình silylation (Chú thích của người dịch: silylation là phản ứng hóa học trong đó các nhóm chức hoạt động (chứa hydro hoạt động) trong một phân tử được thay thế bằng các nhóm trimethylsilyl (-Si(CH3)3) thông qua việc cho phản ứng với các thuốc thử silylation) không cung cấp các dẫn xuất có thể phát hiện được, trong khi việc acetyl hóa (Chú thích của người dịch: Acetyl hóa là một phản ứng hóa học trong đó một nhóm acetyl (CH3CO-) được thêm vào một phân tử, thường là bằng cách thay thế một nguyên tử hydro hoạt động trong một nhóm chức như hydroxyl (-OH), amino (-NH2, -NHR), hoặc thiol (-SH)) làm tăng tín hiệu của các amin bậc hai mephedrone và methylone (HFBA > TFAA > PFPA), nhưng hiệu ứng trên không được quan sát cho MDPV [10]. Ngược lại, Antunes et al. [52] đã thực hiện một nghiên cứu tương tự cho bốn cathinone tổng hợp (4-chloroethcathinone, α-pyrrolidinovalerophenone, 4-chloropyrrolidinovalerophenone và MDPV) bằng cách sử dụng thuốc thử silylation (MSTFA với 5% TMCS) và thuốc thử acetyl hóa (MBTFA). Tác giả đã báo cáo kết quả tốt hơn, không có nhiễu và cải thiện các píc sắc ký, bằng cách sử dụng thuốc thử silylation ngay cả khi ba trong số các hợp chất là amin bậc ba. Các phương pháp dẫn xuất hóa phổ biến nhất được áp dụng để phân tích các cathinone tổng hợp được liệt kê trong Bảng 1.
Bảng 1. Các phương pháp dẫn xuất hoá cho việc phát hiện các cathionone tổng hợp trong máu và/hoặc nước tiểu.
LC là một kỹ thuật linh hoạt hơn và cho phép tách các chất phân tích không bay hơi, dễ bị phân hủy nhiệt và phân cực mà không cần quá trình dẫn xuất hóa. Trong LC, sự tách chất phụ thuộc vào các đặc tính của pha tĩnh của cột phân tích, thành phần của pha động và nhiệt độ cột. Pha đảo là pha tĩnh được sử dụng nhiều nhất để phân tích các cathinone tổng hợp, với các chuỗi alkyl C8 hoặc C18 điển hình [8, 12, 16, 20, 22, 25, 29–35, 37, 39–43, 56–58, 60, 62]. Tuy nhiên, các pha tĩnh phenyl cũng được sử dụng [21, 28, 45, 59] do khả năng tăng cường sự tách của các đồng phân vị trí, vì nhóm phenyl tương tác thông qua các tương tác pi-pi với một số chất phân tích, làm tăng thời gian lưu của chúng trong cột. Hơn nữa, việc sử dụng các pha tĩnh bất đối đặc biệt đã được báo cáo có ích cho việc phân tích đối quang [15, 38].
Thành phần điển hình của pha động là hỗn hợp của dung dịch nước với chất đệm dễ bay hơi và dung dịch hữu cơ. Các dung dịch nước phổ biến nhất được sử dụng là axit formic trong nước [8, 12, 21, 25, 30, 34, 35, 37, 39, 40, 42, 43, 56, 57] hoặc amoni formate với axit formic trong nước [15, 20, 22, 28, 29, 31-33, 45, 60, 62]. Các dung dịch hữu cơ thường là acetonitrile [8, 12, 16, 20, 21, 25, 30–33, 35, 37, 39–43, 57, 58] hoặc methanol [15, 22, 28, 29, 34, 45, 56, 59, 60, 62].
2.2.2. Khối Phổ
Khối phổ là một công cụ mạnh mẽ để phát triển các phương pháp nhạy và đặc hiệu cho cả phân tích định tính và định lượng. Đầu tiên, các phân tử có trong mẫu được ion hóa để tạo ra các phân tử mang điện hoặc các mảnh phân tử tích điện của các phân tử này. Sau đó, các ion này được tách theo tỷ lệ khối lượng trên điện tích (m/z) trong chân không cao bằng cách áp dụng điện trường hoặc từ trường và được xác định tùy thuộc vào số khối và điện tích phân tử tương đối của chúng. Quá trình ion hóa có thể được thực hiện bằng các nguồn ion hoá khác nhau. Nguồn ion hóa phổ biến nhất được kết hợp với GC là ion hóa điện tử (Electrong Ionization - EI) [5, 10, 11, 17, 18, 46, 52–54, 61], mặc dù ion hóa hóa học âm (Negative Chemical Ionization - NCI) [3] cũng có thể được sử dụng. EI là một kỹ thuật ion hóa cứng cung cấp một phổ khối đặc trưng và có thể tái tạo cho mỗi chất phân tích, trong khi NCI là một kỹ thuật ion hóa mềm và cho phổ tương đối đơn giản hơn cũng như có ít mảnh hơn, mặc dù việc sử dụng NCI có thể làm tăng độ nhạy của các hợp chất có ái lực electron cao [3]. Tuy nhiên, các cathinone tổng hợp là các hợp chất tương đối dễ phá mảnh và có thể phân mảnh mạnh trong điều kiện của EI, dẫn đến việc thu được một phổ khối với một số lượng hạn chế các ion chẩn đoán và không đặc hiệu [24, 35]. Việc sử dụng chiến lược dẫn xuất hóa có thể cải thiện phổ khối của các hợp chất này, cũng như số lượng mảnh đặc trưng và độ nhạy của chất phân tích [10, 24, 52].
Khác với GC, nguồn ion hóa phổ biến nhất được kết hợp với LC là ion hóa phun điện tử (Electron Spray Ionization - ESI) [8, 12, 15, 16, 20, 22, 25, 28-35, 37, 39–43, 45, 58–60, 62]. ESI là kỹ thuật ion hóa mềm hơn và có thể khắc phục một số nhược điểm của các phương pháp GC-MS. Hơn nữa, đây là nguồn ion hóa ưu tiên cho các chất phân tích phân cực và được sử dụng rộng rãi để phân tích các cathinone tổng hợp. Phần lớn các phương pháp LC-MS/MS sử dụng bộ 3 tứ cực với kỹ thuật giám sát đa phản ứng (MRM) để phân tích xác nhận và định lượng nhờ độ nhạy và tính đặc hiệu cao [8, 12, 15, 16, 22, 25, 28-34, 37, 40–43, 59, 60]. Tuy nhiên lưu ý rằng với việc phân tích có mục tiêu thì các chất phân tích không có trong phương pháp khối phổ thiết lập sẽ không được phát hiện. Do đó, trong những năm gần đây, việc sử dụng các kỹ thuật có khối phổ với độ phân giải cao (LC-HRMS/MS) [20, 21, 35, 36, 39, 44, 45, 58, 62] ngày càng gia tăng, vì chúng hoạt động ở chế độ quét, thu thập dữ liệu khối lượng độ phân giải cao từ tất cả các chất phân tích có trong mẫu. Để biết thêm thông tin về HRMS trong phân tích NPS, hãy xem Chương 11.
3. Các Thách Thức Phân Tích
3.1. Xác Định Chất Đối Quang
Các cathinone tổng hợp có một trung tâm carbon bất đối (chiral carbon center) tạo ra hai chất đối quang (enantiomer), và thường một hỗn hợp racemic của cả hai đồng phân sẽ được tìm thấy trên thị trường, mặc dù các chất đối quang này có thể có hiệu lực khác nhau và con đường chuyển hóa khác nhau [3, 38]. Ví dụ, hiệu ứng kích thích của (S)-methcathinone cao hơn (R)-methcathinone [3] và vì lý do này không phải tất cả các chất đối quang đều được phân tích [35]. Để xác định và phân biệt các chất đối quang bằng GC hoặc LC-MS(MS), cần có sự tách sắc ký, vì các chất đối quang thường có cùng ion tiền chất và ion sản phẩm [35]. Một số tác giả đã đạt được sự tách chất đối quang của một số cathinone tổng hợp bằng cách sử dụng sắc ký pha đảo truyền thống [23, 35, 37, 43], nhưng nói chung cần một phương pháp chuyên biệt hơn để tách các chất đối quang này.
Sự tách các chất đối quang có thể được thực hiện bằng hai phương pháp khác nhau: bằng cách phân giải sắc ký trực tiếp nhờ sử dụng các cột phân tích với pha tĩnh bất đối (chiral stationary phase) hoặc bằng cách sử dụng các chất phụ gia bất đối (chiral additive) trong pha động hoặc bằng cách dẫn xuất hóa bằng một thuốc thử tinh khiết lập thể (stereochemically pure reagent) chuyển đổi các chất đối quang (enantiomers) thành các chất đồng phân lập thể (diastereoisomers), có các tính chất vật lý hóa học khác nhau và có thể được tách trên các cột sắc ký thông thường (là cột không bất đối – achiral column) [38]. Phương pháp đầu tiên được sử dụng bởi Meetani et al. [38], tác giả đã so sánh hai cột thương mại có sẵn, cột Astec Cellulose DMP và cột Chiralpak AS-H dựa trên amylose, để tách chất đối quang của 22 amin bậc ba. Cột đầu tiên được phủ một lớp cellulose được dẫn xuất dimethylphenyl carbamat có khả năng tách nhiều chất đối quang hơn cột dựa trên amylose, cụ thể là 19 so với 7 chất đối quang có thể được tách hoàn toàn. Phương pháp thứ hai được Alremeithi et al. [3] sử dụng để tách một cách đối quang cho 36 cathinone tổng hợp nhờ sử dụng (S)-(-)-N-(trifluoroacetyl)-pyrrolidine-2-carbonyl chloride (L-TPC). L-TPC là một chất dẫn xuất hóa bất đối, phản ứng với các amin bậc một và bậc hai, từ đó chuyển đổi các chất đối quang thành các chất đồng phân lập thể.
3.2. Độ ổn định của cathinone tổng hợp
Sự không ổn định của thuốc trong quá trình vận chuyển, bảo quản, xử lý và điều kiện phân tích cũng cần được xem xét trong quá trình phát triển phương pháp. Sự phân hủy có thể tạo ra những thay đổi về nồng độ thuốc, hồ sơ trao đổi chất (metabolic profile) và do đó, ảnh hưởng đến việc giải thích các kết quả liên quan tới độc chất. Sự không ổn định của cathinone trong các mẫu thực vật và trong huyết tương đã được báo cáo trong 1 vài nghiên cứu [5, 64], tuy nhiên dữ liệu về sự ổn định của các cathinone tổng hợp còn tương đối hạn chế. Một số nghiên cứu đánh giá các khía cạnh khác nhau về sự ổn định của các cathinone tổng hợp trong mẫu máu và nước tiểu đã được công bố cho một số chất phân tích [5–7, 29, 32, 34, 36, 41–44, 54, 70, 71]. Thêm vào đó, một nghiên cứu đánh giá gần đây đã được công bố tóm tắt các kết quả hiện tại về độ ổn định của các cathinone tổng hợp trong nhiều mẫu sinh học khác nhau [72]. Các phát hiện chính liên quan đến độ ổn định của cathinone tổng hợp trong máu và nước tiểu được tóm tắt như sau:
- Độ ổn định của các cathinone tổng hợp phụ thuộc nhiều vào nhiệt độ, hầu hết chúng đều ổn định ở nhiệt độ đông lạnh (>-20 °C) [5, 7, 29, 32, 36, 41–43, 70, 71].
- Độ pH của mẫu có tác động lớn đến sự phân hủy các cathinone tổng hợp và sự không ổn định của nhiều chất phân tích này đã được báo cáo ở pH trung tính đến bazơ (7-9) [7, 36, 42, 71].
- Việc kiềm hóa các mẫu nước tiểu được bảo quản trong tủ lạnh hoặc ở nhiệt độ phòng làm tăng sự không ổn định của các cathinone tổng hợp trong mẫu [7, 36]. Việc bổ sung một số chất bảo quản, chẳng hạn như natri azide, vào mẫu nước tiểu có thể ngăn chặn sự phát triển của vi khuẩn, dẫn tới sự kiềm hóa các mẫu cũng như sự phân hủy các chất phân tích [7].
- Việc mẫu trải qua nhiều nhiều chu kỳ rã đông và đóng băng đã không cho thấy ảnh hưởng đến sự ổn định của hầu hết các cathinone tổng hợp [6, 7, 29, 34, 43, 44, 54].
- Nồng độ của các chất phân tích trong mẫu dường như không tạo ra sự khác biệt đáng kể về độ ổn định của các cathinone tổng hợp [70, 71].
- Một số cấu trúc hóa học có tác dụng ổn định đáng kể, chẳng hạn như nhóm methylenedioxy hoặc sự có mặt của một nguyên tử flo thay vì nguyên tử clo [5, 7, 70, 71]. Hơn nữa, các nhóm thế trong nhóm methylenedioxy ở cả amin bậc hai và bậc ba có tác dụng ổn định [70, 71]. Ngoài ra, các amin bậc ba (ngoại trừ naphyrone) ổn định hơn các amin bậc hai [7, 36, 43, 70, 71]. Ngược lại, các cấu trúc khác như sự có mặt của vòng benzen hợp nhất làm giảm độ ổn định [5].
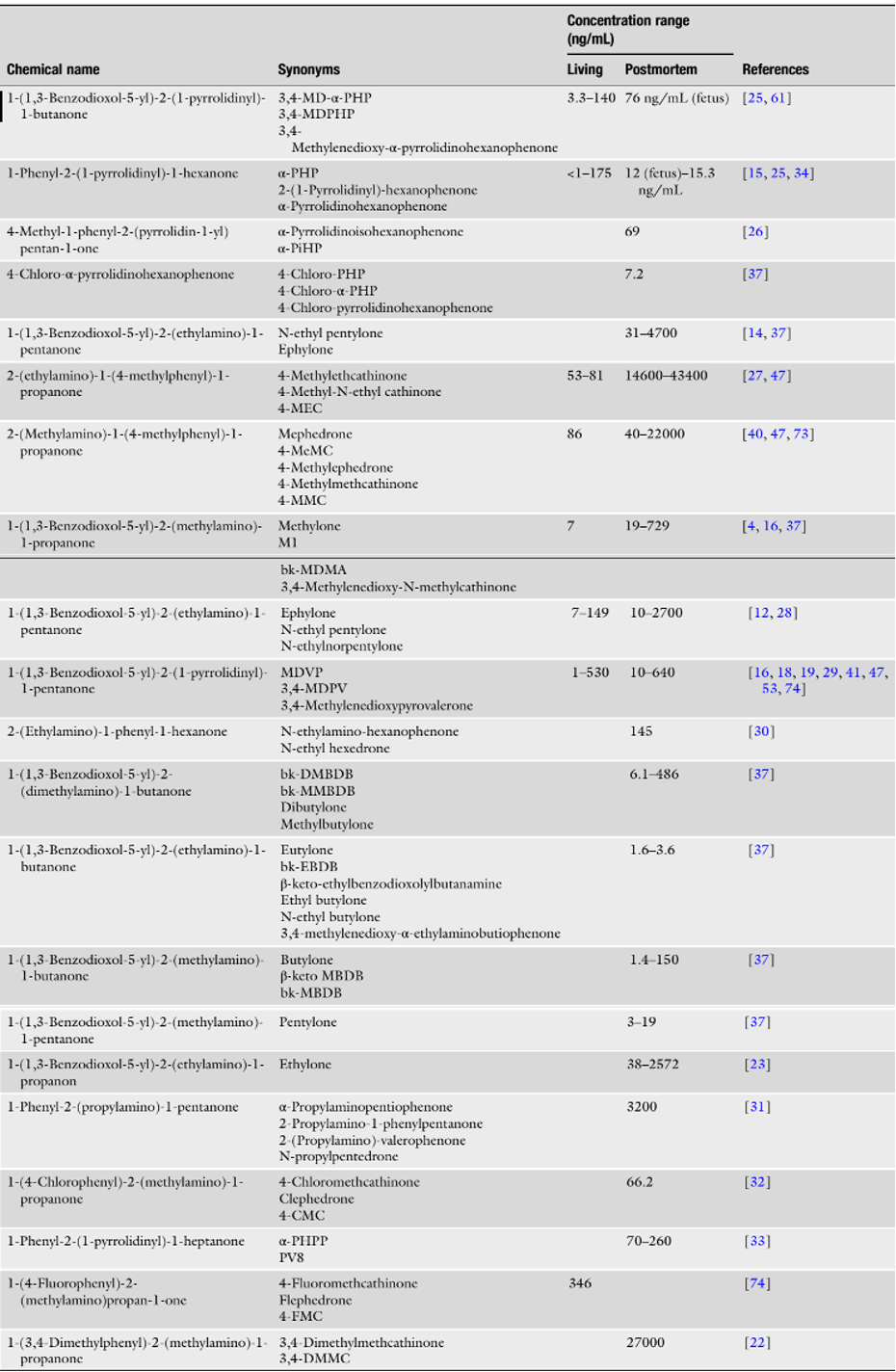
4. Nồng độ trong mẫu máu
Phân tích định lượng các mẫu máu cần thiết trong các trường hợp lâm sàng và pháp y để xác định mức độ suy giảm của cá nhân và sự đóng góp của các chất lạ khác nhau đối với các triệu chứng lâm sàng hoặc nguyên nhân gây tử vong. Không có nhiều dữ liệu về phạm vi nồng độ cho phần lớn các cathinone tổng hợp do tỷ lệ lưu hành thấp của các chất này và thiếu các phương pháp phân tích cụ thể để xác định chúng trong nhiều phòng thí nghiệm độc chất. Bảng 2 cho thấy phạm vi nồng độ trong máu của một vài cathinone tổng hợp được tìm thấy trong các trường hợp lâm sàng và pháp y thực tế. Thông tin bổ sung về nồng độ cathinone tổng hợp trong các trường hợp hoạt động và sau khi chết có thể được tìm thấy trong nghiên cứu của Ellefsen et al. [75].
Bảng 2. Nồng độ các cathinone tổng hợp trong các trường hợp lâm sàng và pháp y thực tế
5. Tài liệu tham khảo
- European Monitoring Centre for Drugs and Drug Addiction and Europol (2019) EU Drug Markets Report 2019, Publications Office of the European Union, Luxembourg. https://www.emcdda.europa.eu/system/files/publications/12078/20192630_TD0319332ENN_PDF.pdf. Accessed date: 10 July 2021
- United Nations Office on Drugs and Crime (2021) World Drug Report 2021, Drug market trends: cocaine, amphetamine type stimulants, United Nations Publication, Vienna, 2021. https://www.unodc.org/res/wdr2021/field/WDR21_Booklet_4.pdf Accessed date: 10 July 2021
- Alremeithi R, Meetani MA, Alaidaros AA, Lanjawi A, Alsumaiti K (2018) Simultaneous quantitative determination of synthetic cathinone enantiomers in urine and plasma using GC-NCI-MS. J Anal Methods Chem 2018:4396043
- Carbone PN, Carbone DL, Carstairs SD, Luzi SA (2013) Sudden cardiac death associated with methylone use. Am J Forensic Med Pathol 34(1):26-28
- Ciallella HL, Rutter LR, Nisbet LA, Scott KS (2020) Extended stability evaluation of selected cathinones. Front Chem 8:597726
- Margalho C, Almeida P, Rosado T, Corte Real F, Gallardo E (2020) Determination of new psychoactive substances in whole blood using microwave fast derivatization and gas chromatography/mass spectrometry. J Anal Toxicol 44(1):92-102
- Adamowicz P, Malczyk A (2019) Stability of synthetic cathinones in blood and urine. Forensic Sci Int 295:36-45
- Carrola J, Duarte N, Florindo P, Henriques S, da Silva G, Bijlsma L, Moreira R, Correia C, Perry MJ, Lopes A, de Mello-Sampayo C, do Rosário Bronze M (2020) Metabolism of N-ethylhexedrone and buphedrone: an in vivo study in mice using HPLC-MS/MS. J Chromatogr B Analyt Technol Biomed Life Sci 1159:122340
- Klavž J, Gorenjak M, Marinšek M (2016) Suicide attempt with a mix of synthetic cannabinoids and synthetic cathinones: Case report of non-fatal intoxication with AB-CHMINACA, AB-FUBINACA, alpha-PHP, alpha-PVP and 4-CMC. Forensic Sci Int 265:121-124
- Alexandridou A, Mouskeftara T, Raikos N, Gika HG (2020) GC-MS analysis of underivatised new psychoactive substances in whole blood and urine. J Chromatogr B Analyt Technol Biomed Life Sci 1156:122308
- Hong WY, Ko YC, Lin MC, Wang PY, Chen YP, Chiueh LC, Shih DYC, Chou HH, Chen HF (2016) Determination of synthetic cathinones in urine using gas chromatography-mass spectrometry techniques. J Anal Toxicol 40(1):12-16
- Giachetti AD, Kahl JH, Zaney ME, Hime GW, Boland DM (2020) Method validation of seven synthetic cathinones by LC-MS/MS analysis and the prevalence of N-ethylpentylone in postmortem casework. J Anal Toxicol Bkaa 194. Online ahead of print.
- Adamowicz P (2021) Blood concentrations of synthetic cathinones. Clin Toxicol (Phila) 59(7):648-654
- Atherton D, Dye D, Robinson CA, Beck R (2019) N-ethyl pentylone-related deaths in Alabama. J Forensic Sci 64(1):304-308
- Fujita Y, Mita T, Usui K, Kamijo Y, Kikuchi S, Onodera M, Fujino Y, Inoue Y (2018) Toxicokinetics of the synthetic cathinone a-pyrrolidinohexanophenone. J Anal Toxicol 42(1):el-e5
- Marinetti LJ, Antonides HM (2013) Analysis of synthetic cathinones commonly found in bath salts in human performance and postmortem toxicology: method development, drug distribution and interpretation of results. J Anal Toxicol 37(3):135-146
- Gerace E, Caneparo D, Borio F, Salomone A, Vincenti M (2019) Determination of several synthetic cathinones and an amphetamine-like compound in urine by gas chromatography with mass spectrometry. Method validation and application to real cases. J Sep Sci 42(8):1577-1584
- Wyman JF, Lavins ES, Engelhart D, Armstrong EJ, Snell KD, Boggs PD, Taylor SM, Norris RN, Miller FP (2013) Postmortem tissue distribution of MDPV following lethal intoxication by "bath salts". J Anal Toxicol 37(3):182-185
- Spiller HA, Ryan ML, Weston RG, Jansen J (2011) Clinical experience with and analytical confirmation of “bath salts" and "legal highs" (synthetic cathinones) in the United States. Clin Toxicol (Phila) 49(6):499–505
- Bertol E, Mari F, Berto RB, Mannaioni G, Vaiano F, Favretto D (2014) A mixed MDPV and benzodiazepine intoxication in a chronic drug abuser: determination of MDPV metabolites by LC-HRMS and discussion of the case. Forensic Sci Int 243:149-155
- Anizan S, Ellefsen K, Concheiro M, Suzuki M, Rice KC, Baumann MH, Huestis MA (2014) 3,4-Methylenedioxypyrovalerone (MDPV) and metabolites quantification in human and rat plasma by liquid chromatography-high resolution mass spectrometry. Anal Chim Acta 827:54-63
- Usui K, Aramaki T, Hashiyada M, Hayashizaki Y, Funayama M (2014) Quantitative analysis of 3,4-dimethylmethcathinone in blood and urine by liquid chromatography-tandem mass spectrometry in a fatal case. Leg Med (Tokyo) 16(4):222–226
- Lee D, Chronister CW, Hoyer J, Goldberger BA (2015) Ethylone-Related Deaths: Toxicological Findings. J Anal Toxicol 39(7):567-571
- LaPointe J, Musselman B, O'Neill T, Shepard JRE (2015) Detection of “bath salt" synthetic cathinones and metabolites in urine via DART-MS and solid phase microextraction. J Am Soc Mass Spectrom 26(1):159–165
- Adamowicz P, Hydzik P (2019) Fetal death associated with the use of 3,4-MDPHP and α-PHP. Clin Toxicol (Phila) 57(2):112-116
- Adamowicz P, Jurczyk A, Gil D, Szustowski S (2020) A case of intoxication with a new cathinone derivative a-PiHP a presentation of concentrations in biological specimens. Leg Med (Tokyo) 42:101626
- Braham MY, Franchi A, Cartiser N, Bévalot F, Bottinelli C, Fabrizi H, Fanton L (2021) Fatal 4-MEC intoxication: case report and review of literature. Am J Forensic Med Pathol 42(1):57-61
- Costa JL, Francisco Cunha K, Lanaro R, Leal Cunha R, Walther D, Baumann MH (2019) Analytical quantification, intoxication case series, and pharmacological mechanism of action for N-ethylnorpentylone (N-ethylpentylone or ephylone). Drug Test Anal 11(3):461-471
- Diestelmann M, Zangl A, Herrle I, Koch E, Graw M, Paul LD (2018) MDPV in forensic routine cases: psychotic and aggressive behavior in relation to plasma concentrations. Forensic Sci Int 283:72-84
- Domagalska E, Banaszkiewicz L, Woźniak MK, Kata M, Szpiech B, Kaliszan M (2021) Fatal N-ethylhexedrone intoxication. J Anal Toxicol 45(6):el-e6
- Majchrzak M, Celiński R, Kowalska T, Sajewicz M (2018) Fatal case of poisoning with a new cathinone derivative: α-propylaminopentiophenone (N-PP). Forensic Toxicol 36(2):525-533
- Nowak C, Szpot P, Zawadzki M (2020) The stability of 4-chloromethcathinone in blood and vitreous humor. J Forensic Sci 65(5):1784-1790
- Pieprzyca E, Skowroneka R, Korczyńska M, Kulikowska J, Chowaniec M (2018) A two fatal cases of poisoning involving new cathinone derivative PV8. Leg Med (Tokyo) 33:42-47
- Vignali C, Moretti M, Groppi A, Osculati AMM, Tajana L, Morini L (2019) Distribution of the synthetic cathinone α-pyrrolidinohexiophenone in biological specimens. J Anal Toxicol 43(1):e1-e6
- Glicksberg L, Bryand K, Kerrigan S (2016) Identification and quantification of synthetic cathinones in blood andurine using liquid chromatography-quadrupole/time of flight (LC-Q/TOF) mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 1035:91-103
- Glicksberg L, Rana S, Kerrigan S (2018) Cathinone stability in authentic urine specimens. Forensic Sci Int 286:54-60
- Lau T, Concheiro M, Cooper G (2020) Determination of 30 synthetic cathinones in postmortem blood using LC-MS-MS. J Anal Toxicol 44(7):679-687
- Meetani MA, Alremeithi RH, Mousa MK (2019) Enantioseparation of synthetic cathinones enantiomers with tertiary amine structure in urine and plasma. J Chromatogr Sci 57(4):361-368
- Montesano C, Vannutelli G, Gregori A, Ripani L, Compagnone D, Curini R, Sergi M (2016) Broad screening and identification of novel psychoactive substances in plasma by high-performance liquid chromatography-high-resolution mass spectrometry and post-run library matching. J Anal Toxicol 40(7):519-528
- Vaiano F, Busardò FP, Palumbo D, Kyriakou C, Fioravanti A, Catalani V, Maria F, Bertol E (2016) A novel screening method for 64 new psychoactive substances and 5 amphetamines in blood by LC-MS/MS and application to real cases. J Pharm Biomed Anal 129:441-449
- Wang Y, Shi Y, Yu Y, Chen L, Jiang J, Long J, Xiang P, Duan G (2021) Screening of synthetic cathinones and metabolites in dried blood spots by UPLC-MS-MS. J Anal Toxicol 45(7):633-643
- Al-Saffar Y, Stephanson NN, Beck O (2013) Multicomponent LC-MS/MS screening method for detection of new psychoactive drugs, legal highs, in urine-Experience from
- Concheiro M, Anizan S, Ellefsen K, Huestis MA (2013) Simultaneous quantification of 28 synthetic cathinones and metabolites in urine by liquid chromatography-high resolution mass spectrometry. Anal Bioanal Chem 405(29):9437-9448
- Concheiro M, Castaneto M, Kronstrand R, Huestis MA (2015) Simultaneous determination of 40 novel psychoactive stimulants inurine by liquid chromatography-high resolution mass spectrometryand library matching. J Chromatogr A 1397:32-42
- Fan SY, Zang CZ, Shih PH, Ko YC, Hsu YH, Lin MC, Tseng SH, Wang DY (2020) A LC-MS/MS method for determination of 73 synthetic cathinones and related metabolites in urine. Forensic Sci Int 315:110429
- Uralets V, Rana S, Morgan S, Ross W (2014) Testing for designer stimulants: metabolic profiles of 16 synthetic cathinones excreted free in human urine. J Anal Toxicol 38(5):233-241
- Mercolini L, Protti M, Catapano MC, Rudge J, Sberna AE (2016) LC-MS/MS and volumetric absorptive microsampling for quantitative bioanalysis of cathinone analogues in dried urine, plasma and oral fluid samples. J Pharm Biomed Anal 123:186–194
- Thornton SL, Gerona RR, Tomaszewski CA (2012) Psychosis from a bath salt product containing flephedrone and MDPV with serum, urine, and product quantification. J Med Toxicol 8(3):310-313
- Zaami S, Giorgetti R, Pichini S, Pantano F, Marinelli E, Busardò FP (2018) Synthetic cathinones related fatalities: an update. Eur Rev Med Pharmacol Sci 22(1):268–274
- Jones AW (2016) Introduction to forensic toxicology and the value of a nationwide database. In: Davies S, Johnston A, Holt D (eds) Forensic toxicology. drug use and misuse, 1st edn. The Royal Society of Chemistry, pp 1-29
- Hagan KS, Reidy L (2015) Detection of synthetic cathinones in victims of sexual assault. Forensic Sci Int 257:71-75
- Antunes M, Sequeira M, de Caires PM, João Caldeira M, Santos S, Franco J, Barroso M, Gaspar H (2021) Determination of selected cathinones in blood by solid-phase extraction and GC-MS. J Anal Toxicol 45(3):233-242
- Grapp M, Kaufmann C, Ebbecke M (2017) Toxicological investigation of forensic cases related to the designer drug 3,4-methylenedioxypyrovalerone (MDPV): Detection, quantification and studies on
- Margalho C, Castanheira A, Corte Real F, Gallardo E, López-Rivadulla M (2016) Determination of "new psychoactive substances" in postmortem matrices using microwave derivatization and gas chromatography-mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 1020:14-23
- Švidrnoch M, Lněníčková L, Válka I, Ondra P, Maier V (2014) Utilization of micellar electrokinetic chromatography-tandem mass spectrometry employed volatile micellar phase in the analysis of cathinone designer drugs. J Chromatogr A 1356:258-265
- Strickland EC, Cummings OT, Mellinger AL, McIntire JL (2019) Development and validation of a novel all-inclusive LC-MS-MS designer drug method. J Anal Toxicol 43(3):161-169
- Fernández P, González M, Regenjo M, Aresa AM, Fernández AM, Lorenzo RA, Carro AM (2017) Analysis of drugs of abuse in human plasma using microextraction bypacked sorbents and ultra-high-performance liquid chromatography. J Chromatogr A 1485:8–19
- Ishii A, Kusakabe K, Na K, Sasaki S, Tsujikawa K, Wada T (2020) Studies on the phase I metabolites of the new designer drug 1-(2,3-dihydro-1H-inden-5-yl)-2-(pyrrolidine-1-yl)butan-1-one (5-PPDI) in human urine. Forensic Sci Int 310:110214
- Murakami Y, Iwamuro Y, Ishimaru R, Chinaka S, Hasegawa H (2018) Molecularly imprinted polymer solid-phase extraction of synthetic cathinones from urine and whole blood samples. J Sep Sci 41(24):4506-4514
- Sánchez-González J, Odoardi S, Bermejo AM, Bermejo-Barrera P, Romolo FS, Moreda-Piñeiro A, Strano-Rossi S (2019) HPLC-MS/MS combined with membrane-protected molecularly imprinted polymer micro-solid-phase extraction for synthetic cathinones monitoring in urine. Drug Test Anal 11(1):33-44
- Grapp M, Kaufmann C, Schwelm HM, Neukamm MA, Blaschke S, Eidizadeh A (2020) Intoxication cases associated with the novel designer drug 3',4'-methylenedioxy-apyrrolidinohexanophenone and studies on its human metabolism using high-resolution mass spectrometry. Drug Test Anal 12(9):1320–1335
- Kavanagh P, Gofenberg M, Shevyrin V, Dvorskaya O, Dowling G, Grigoryev A (2020) Tentative identification of the phase I and II metabolites of two synthetic cathinones, MDPHP and α-PBP, in human urine. Drug Test Anal 12(10):1442-1451
- Lendoiro E, de Castro A, Fernández-Vega H, Cela-Pérez MC, López-Vilariño JM, González-Rodríguez MV, Cruz A, López-Rivadulla M (2014) Molecularly imprinted polymer for selective determination of Δ9-tetrahydrocannabinol and 11-nor-Δ9-tetrahydrocannabinol carboxylic acid using LC-MS/MS in urine and oral fluid. Anal Bioanal Chem 406(15):3589-3597
- Morad A, Al-Meshal I, Nasir M, El-Feraly F (1989) High performance liquid chromatographic determination of (-)-cathinone in plasma. Chromatographia 27:201-204
- Paul BD, Cole KA (2001) Cathinone (Khat) and methcathinone (CAT) in urine specimens: a gas chromatographic-mass spectrometric detection procedure. J Anal Toxicol 25:525-530
- Sørensen LK (2011) Determination of cathinones and related ephedrines in forensic whole-blood samples by liquid-chromatography-electrospray tandem mass spectrometry. J Chromatogr B 879:727–736
- Johnson RD, Botch-Jones SR (2013) The stability of four designer drugs: MDPV, mephedrone, BZP and TFMPP in three biological matrices under various storage conditions. J Anal ToxicoL 37:51-55
- Soh YN, Elliott S (2013) An investigation of the stability of emerging new psychoactive substances. Drug Test Anal 6:696–704
- Kerrigan S, Savage M, Cavazos C, Bella P (2016) Thermal degradation of synthetic cathinones: implications for forensic toxicology. J Anal Toxicol 40:1-11
- Glicksberg L, Kerrigan S (2017) Stability of synthetic cathinones in blood. J Anal toxicol 41(9):711-719
- Glicksberg L, Kerrigan S (2018) Stability of synthetic cathinones in urine. J Anal Toxicol 42(2):77-87
- Aldubayyan AA, Castrignanò E, Elliott S, Abbate V (2021) Stability of synthetic cathinones in clinical and forensic toxicological analyses-where are we now? Drug Test Anal 13(1):44-68
- Busardò FP, Kyriakou C, Napoletano S, Marinelli E, Zaami S (2015) Mephedrone related fatalities: a review. Eur Rev Med Pharmacol Sci 19(19):3777–3790
- Thornton SL, Gerona RR, Tomaszewski CA (2012) Psychosis from a bath salt product containing flephedrone and MDPV with serum, urine, and product quantification. J Med Toxicol 8:310-313
- Ellefsen KN, Concheiro M, Huestis MA (2016) Synthetic cathinones pharmacokinetics, analytical methods, and toxicological findings from human performance and postmortem cases. Drug Metab Rev 48(2):237-265