
Đang tải...

Đang tải...
Keywords: QqQ, QTRAP, QTOF, LC-MS/MS, MRM-IDA-EPI, HRMS, HRMS/MS, novel pyschoactive subtances, multi-targeted screening, non-targeted analysis, biological samples, urine, khối phổ ba lần tứ cực, bẫy ion tuyến tính, phổ ion tăng cường, sàng lọc đa mục tiêu diện rộng, khối phổ tứ cực thời gian bay, phổ khối phân giải cao, phân tích không mục tiêu, mẫu sinh học, nước tiểu.
Giới thiệu: Bài viết này sẽ cung cấp cho bạn đọc một số khái niệm cơ bản liên quan tới khối phổ ba tứ cực lai bẫy ion tuyến tính (Linear Ion Trap – LIT) với tên gọi thương mại là QTRAP, khối phổ phân giải cao tứ cực thời gian bay (QTOF), kỹ thuật ghi tín hiệu tự động dựa trên thông tin thu được (IDA) và trình bày quan điểm của tác giả liên quan tới việc sàng lọc và phát hiện chất cấm trong mẫu nước tiểu. Về tác giả, TS. Lê Sĩ Hưng, tốt nghiệp tiến sĩ tại đại học BOKU Vienna (Cộng hoà Áo) ngành hoá phân tích, đã có trên 10 năm kinh nghiệm làm việc với các thiết bị khối phổ, tập trung vào ứng dụng các kỹ thuật khối phổ trong phân tích các chất chuyển hoá (metabolites) và protein trong các đối tượng mẫu sinh học, ORCID: 0000-0002-0762-3492.
1. Xác định tin cậy chất trong nền mẫu sinh học
Trong lĩnh vực độc học và pháp y, liên quan tới yêu cầu xác định tin cậy các chất cấm trong nền mẫu sinh học, 5 cấp độ định danh tin cậy đề xuất bởi Schymanski được chấp nhận rộng rãi bởi nhiều nhóm nghiên cứu trên thế giới chỉ ra rằng việc ghi phổ MS/MS của chất quan tâm đóng vai trò rất quan trọng xuyên suốt trong toàn bộ quá trình định danh tin cậy
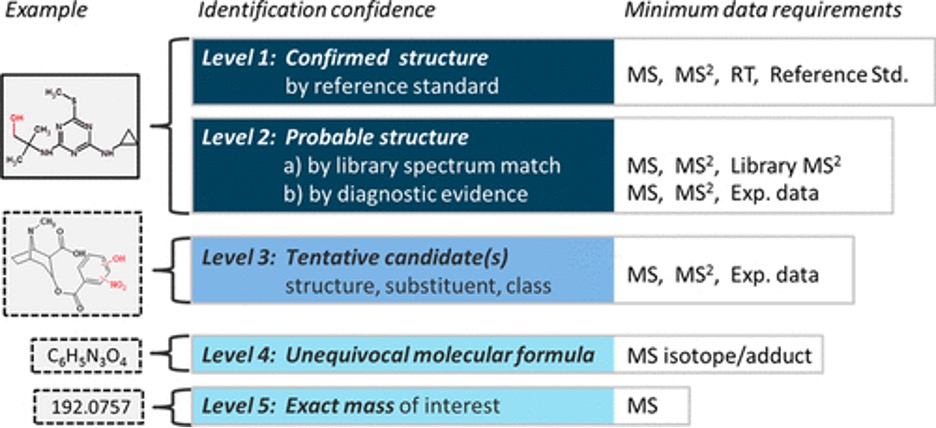
Hình 1. Các cấp độ định danh tin cậy một chất, cấp 1 là tin cậy nhất.
Theo 5 cấp độ tin cậy này, các thiết bị khối phổ 3 tứ cực (QqQ) thông thường sẽ khó để cung cấp được nhiều thông tin yêu cầu cho việc định danh tin cậy chất. Cho mục đích này, khối phổ tứ cực ghép nối thời gian bay (QTOF) và các máy khối phổ dựa trên khả năng bẫy ion (QTRAP) có ưu thế hơn so với QqQ nhờ độ nhạy và tốc độ quét tốt hơn ở chế độ "fulll scan" (quét toàn dải phổ). Các thiết bị QTOF là khối phổ phân giải cao (HRMS), nhờ khả năng phân giải các ion dựa trên thời gian bay trong ống (bay). Các ion trước khi tiến vào ống bay được cung cấp cùng 1 động năng, di chuyển tiến vào ống bay. Ion nhẹ bay nhanh hơn ion nặng và dần tách ra khỏi nhau trên đường di chuyển. Nhờ sử dụng các gương phản xạ (reflectron) đường bay của các ion có thể được kéo dài và do đó tăng thêm khả năng phân giải khối. Các thiết bị QTOF có thể cung cấp độ phân giải khối lên tới ≥ 30.000 với độ chính xác khối (mass accuracy) cao ≤ 2 ppm (khi được hiệu chỉnh phù hợp). Nhờ khả năng cung cấp phân giải, độ chính xác khối cao cho cả MS và MS/MS, kết hợp với tốc độ quét “full scan” cao, các thiết bị QTOF rất thích hợp cho các ứng dụng phân tích không mục tiêu, cũng như để phân tích các chất chưa biết hoặc các chất có trong danh sách tình nghi.
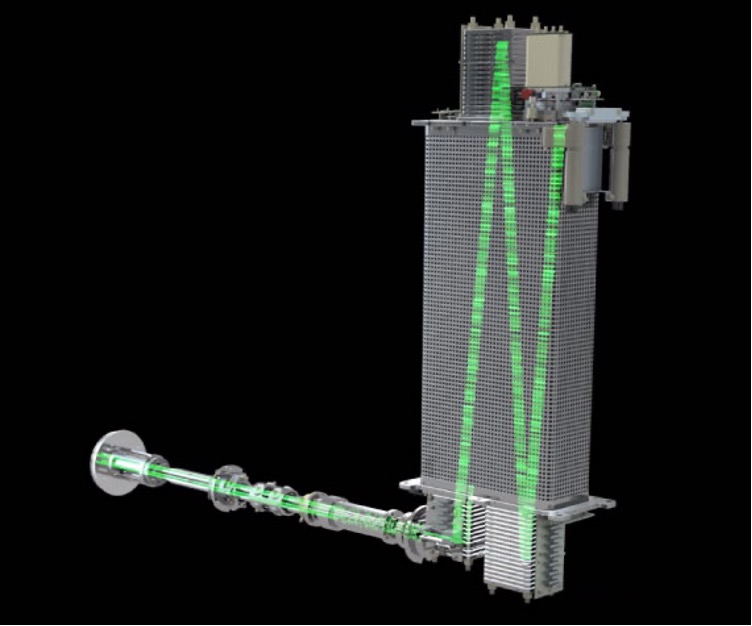
Hình 2. Mô tả sự di chuyển của ion trong hệ thống QTOF (màu xanh lá)
QTRAP là hệ thống khối phổ lai giữa QqQ và bẫy ion tuyến tính (LIT), là giải pháp nâng cấp cho QqQ mà SCIEX mang tới cho người sử dụng. QTRAP vừa duy trì những ưu điểm về độ nhạy và độ đặc hiệu của hệ QqQ trong phân tích định lượng, vừa hỗ trợ mạnh mẽ cho các yêu cầu phân tích định tính với khả năng ghi được toàn dải phổ ion phân mảnh chất lượng cao (chế độ ghi phổ phân mảnh tăng cường – EPI) cho phép sử dụng để đối chiếu với thư viện phổ MS/MS. Điểm làm hệ thống QTRAP độc đáo nằm ở chỗ Q3 được thiết kế và có thể vận hành như một bẫy ion tuyến tính (LIT) cung cấp thêm các tính năng quét định tính mạnh mẽ để tăng cường năng suất cũng như sự linh động cho người sử dụng (Hình 3). Điều này cho phép phát hiện một hợp chất với các MRM chọn lọc và xác nhận tin cậy dựa trên việc ghi phổ MS/MS tự động với chất lượng cao (chế độ MRM-IDA-EPI). Trong chế độ EPI, khác với QqQ thông thường, các ion phân mảnh rời khỏi buồng va chạm (Q2) và tiến vào LIT, sau đó các ion này có thể được bắt giữ trong khoảng thời gian cỡ mili-giây (ví dụ: 50 mili-giây), quét và ghi tín hiệu nhanh 1 cách lần lượt mà không gây mất thông tin (khi ion này đang được ghi tín hiệu các ion khác vẫn tồn tại trong bẫy mà không bị mất đi) (Hình 3). Việc áp dụng chế độ EPI giúp người dùng ghi lại các phổ MS/MS đặc trưng với “duty cycle” ngắn hơn, chất lượng cao hơn và cho phép đối chiếu các phân mảnh thu được với thư viện phổ MS/MS giúp hạn chế tình trạng dương tính giả.
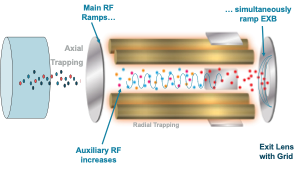
Hình 3. Mô tả cấu tạo của bẫy ion tuyến tính trên các hệ QTRAP của Sciex, trong đó 2 điện cực được thêm vào ở phía trước và phía sau của Q3 kết hợp với các điện cực phụ trợ ở gần cuối Q3, cho phép đóng mở để bắt giữ, kiểm soát và quét các ion ra khỏi bẫy.
Chế độ EPI trên QTRAP cung cấp thêm thông tin định danh chất ở mức độ 3 và 2 liên quan tới phổ phân mảnh và đối chiếu với thư viện phổ. Trong chế độ ghi phổ phân mảnh tăng cường, ion mẹ sẽ được chọn lọc ở Q1 với cửa sổ khối từ 1 – 4 amu, phá mảnh ở Q2, toàn bộ ion con sinh ra sẽ được bắt giữ trong LIT và có thể được quét với 3 mức tốc độ phù hợp với độ phân giải khối yêu cầu. Ở chế độ ghi phổ EPI, năng lượng phá mảnh (collision energy – CE) có thể được thay đổi nhanh chóng ở nhiều mức (e.g., CE từ 20, 35, 50), phổ phân mảnh ở từng mức CE sẽ đều được ghi lại và kết hợp chung trên 1 phổ EPI duy nhất, từ đó cung cấp thông tin phân mảnh toàn diện nhất có thể. EPI cho phép cung cấp phổ MS/MS với độ nhạy cao và chất lượng cao hơn rất nhiều so với chế độ quét phổ ion con trên QqQ thường nhờ khả năng bắt giữ và phân tích toàn bộ các ion con sinh ra bằng LIT. So với việc định danh chất dựa trên tỉ lệ các mảnh con, việc đối chiếu toàn dải phổ MS/MS thu được của chất với thư viện phổ MS/MS (ví dụ: thư viện NIST17, Sciex forensics…) cho độ tin cậy cao hơn rất nhiều, do nhiều thông tin mảnh con được sử dụng để tham chiếu hơn. Và do vậy, việc ghi được phổ MS/MS toàn dải với độ nhạy cao và chất lượng cao chính là mảnh ghép quan trọng cho phép tăng cường độ tin cậy khi định danh dựa trên đối chiếu với thư viện phổ MS/MS (Hình 4).
Information Dependent Acquistion – IDA là thuật ngữ chỉ chung cho chế độ ghi tín hiệu MS/MS tự động áp dụng trên các hệ thống SCIEX QTOF và QTRAP. Trong đó, việc ghi tín hiệu IDA (hoặc gọi là IDA experiment) được bắt đầu với việc sử dụng một “survery scan” (quét thăm dò). Ví dụ: “Survey scan” trong trường hợp của QTOF sẽ là 1 “full scan” từ 50 – 1000 Da, trong QTRAP có thể là 1 loạt các MRM/SRM đặc hiệu của các chất phân tích cần quan tâm. Thông tin thu được từ các “survey scan” (thường là cường độ tín hiệu) sẽ được sử dụng làm tiêu chí để kích hoạt việc ghi phổ MS/MS 1 cách tự động. Như vậy, một “IDA experiment” trong QTOF sẽ thường bắt đầu với “full MS scan” sau đó phần mềm chọn ra các ion mẹ tiềm năng dựa trên cường độ tín hiệu từ cao tới thấp, lần lượt phá mảnh các ion mẹ có tín hiệu vượt ngưỡng nhất định và ghi lại toàn bộ phổ phân mảnh phân giải cao (HRMS/MS). Trong QTRAP, “IDA experiment” thường được thiết kế như sau, vài chục tới vài trăm MRM/SRM đặc hiệu, có độ nhạy tốt của các chất quan tâm sẽ được ghi tín hiệu trước, phần mềm sẽ chọn ra các ion mẹ tiềm năng dựa trên tín cường độ tín hiệu thu được từ MRM/SRM (từ cao tới thấp), lần lượt phá mảnh các ion mẹ có tín hiệu MRM/SRM vượt ngưỡng nhất định và ghi lại phổ EPI của các ion này
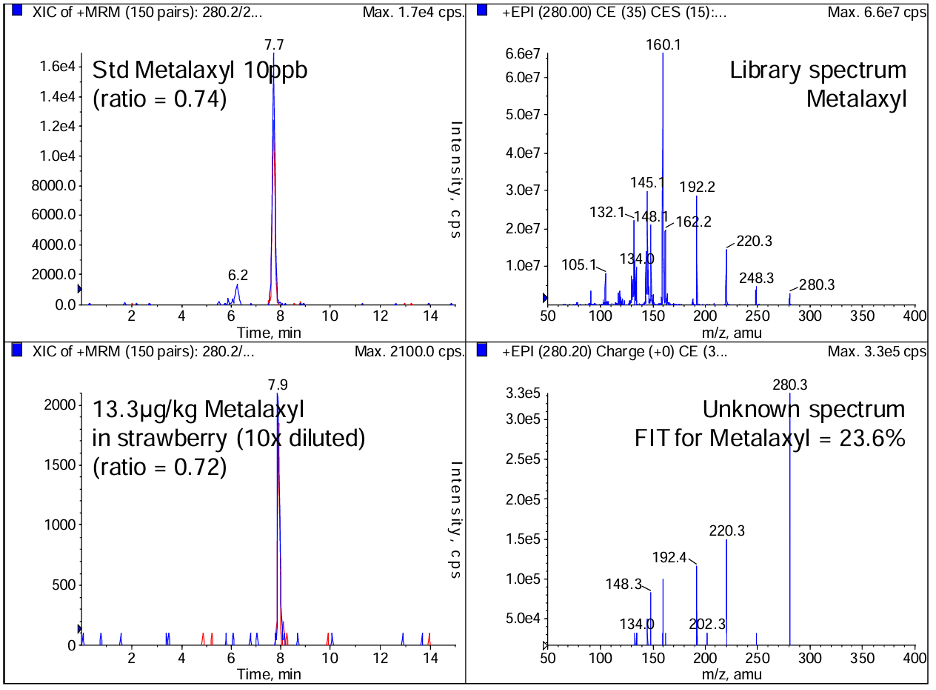
Hình 4. Khi định danh chất chưa biết trên nền mẫu thực phẩm dựa trên thời gian lưu và tỉ lệ ion, kết quả chỉ ra tương đồng cao với metalaxyl (hình bên trái). Tuy nhiên phổ EPI của chất chưa biết tiết lộ chất này chỉ khớp < 24% với phổ MS/MS của metalaxyl trong thư viện.
2. So sánh khả năng của SCIEX QTOF và QTRAP cho ứng dụng xác nhận các chất liên quan tới độc học và pháp y
Thoren và đồng nghiệp đã thực hiện nghiên cứu so sánh hiệu quả trong việc xác định 169 chất liên quan tới lĩnh vực độc học và pháp y trong mẫu nước tiểu sử dụng 2 thiết bị SCIEX QTOF 5600 và SCIEX QTRAP 3200
2.1. Chuẩn bị mẫu
2.2. Phương pháp sắc ký
Mẫu được lọc và pha loãng 5 lần, 10 μL mẫu được bơm lên cột Kinetx 2,6 µm C18 (3 x 50 mm). Pha động A là 0,05% FA trong 5 mM NH4FA trong nước, pha động B là 0,05% FA trong 50:50/MeOH:ACN. Chương trình rửa giải: B tăng tuyến tính từ 2 – 98% trong 10 phút, rửa cột vói 100% B trong 2 phút và tái cân bằng cột ở 2% B trong 2 phút tiếp theo. Tổng thời gian chạy LC:14 phút; Tốc độ dòng: 400 μL/phút; Nhiệt độ cột: 30 °C.
2.3. Phương pháp khối phổ
2.3.1. Phương pháp phân tích xác nhận đa mục tiêu diện rộng với QTRAP
Phân tích xác nhận đa mục tiêu diện rộng được thực hiện với hệ QTRAP 3200 trang bị nguồn ion hoá ESI TurboIon Spray, sử dụng kỹ thuật IDA. Trong đó, một việc quét thăm dò sử dụng 169 Selected Ion Monitoring (SRM) của các chất quan tâm được tiến hành trước, khi tín hiệu của 1 SRM bất kỳ vượt quá 400 cps phần mềm sẽ coi ion mẹ liên quan tới SRM đó là ion mẹ tiềm năng và tự động kích hoạt việc ghi phổ EPI (tối đa 3 ion mẹ có cường độ tín hiệu lớn nhất cho 1 survery scan) ở 3 mức năng lượng CE = 20, 35 và 50 V. Các thông số liên quan khác bao gồm: Mass tolerance = 250 mDa; Tốc độ quét EPI = 4000 Da/giây; Kích hoạt chế độ bắt giữ ion với Q0; Thời gian làm đầy bẫy (fill time) = 50 mili giây.
2.3.2. Phương pháp phân tích không mục tiêu với QTOF
Phân tích không mục tiêu được thực hiện trên hệ QTOF 5600 trang bị nguồn ion hoá ESI DuoSpray. Việc quét thăm dò TOF MS full scan được thực hiện cho số khối trong khoảng 50 – 700 Da và chế độ IDA tự động kích hoạt ghi phổ ion sản phẩm cho tối đa 20 ion mẹ có tín hiệu vượt ngưỡng 100 cps. Thiết bị được hoạt động ở độ phân giải khối 30.000 cho TOF MS scan, và 15.000 cho quét ion sản phẩm (chế độ độ nhạy cao). Hệ được hiệu chỉnh khối bằng dung dịch hiệu chuẩn sau mỗi 5 mẫu phân tích.
2.3.3. Thẩm định phương pháp
LOD của các chất cấm được xác định bằng việc thêm vào mẫu trắng nước tiểu ở 8 mức nồng độ từ 5 – 500 ng/mL. Các mẫu đều được bơm lặp 2 lần, LOD được xác định với nồng độ thấp nhất thoả mãn 2 tiêu chí: Chất cấm xác định phải dương tính với tiêu chí chấm điểm tham chiếu thư viện và có tỉ lệ S/N > 20.
Ảnh hưởng từ nền mẫu (ME) được đánh giá bằng cách thêm chuẩn vào 3 nền mẫu khác nhau ở 2 mức nồng độ 100 hoặc 500 ng/mL. Mẫu được bơm lặp 3 lần. ME được tính theo công thức:
Trong đó: B là tín hiệu trung bình của chất trong mẫu nước tiểu và A là tín hiệu trong nước.
Để so sánh khả năng của 2 phương pháp khối phổ, 100 mẫu nước tiểu được phân tích cho cùng 169 hợp chất. Kết quả phân tích 100 mẫu nước tiểu này được xác nhận lại bằng việc sử dụng Orbitrap, GC-MS, cũng như hồ sơ sử dụng thuốc của bệnh nhân. Các chất cấm và metabolite liên quan tới chúng được gộp thành 1 nhóm, ví dụ nếu benzoylecgonine và/hoặc cocaine được phát hiện trong mẫu bệnh phẩm, chúng chỉ được tính là cocaine.
2.3.4. Xử lý dữ liệu
Dữ liệu phân tích không mục tiêu từ QTOF được xử lý theo kiểu phân tích có mục tiêu cho cùng 169 hợp chất sử dụng trong phương pháp QTRAP. Các thông số xử lý số liệu cho QTOF bao gồm: Cửa sổ Extraced Ion Chromagoram (XIC): 30 ppm; cửa sổ thời gian lưu để tìm píc: 0,5 phút; tín hiệu nhỏ nhất của píc: 1 cps. Các ion phù hợp với 3 tiêu chí trên sẽ được tính điểm tin cậy kết hợp dựa trên các thông số khác bao gồm: Sai số của số khối mảnh mẹ, sai số về thời gian lưu của chất, kiểu dạng đồng vị và độ khớp của phổ phân mảnh thu được với thư viện. Một chất được coi là dương tính nếu điểm tin cậy (combined score) ≥ 70 theo công thức sau đây:
Các trọng số trong các phương trình tính điểm trên được đưa ra dựa trên việc phân tích điểm tin cậy của các mẫu đã biết (thường là mẫu LOD).
3. Kết quả
3.1. LOD
Với QTOF, 39% các chất có LOD = 5 ng/mL, 19% chất có LOD = 10 ng/mL và 12% chất có LOD = 25 ng/mL. Với QTRAP, 51% các chất có LOD = 5 ng/mL, 14% chất có LOD = 10 ng/mL và 11% chất có LOD = 25 ng/mL. Cả 2 phuơng pháp có cùng LOD cho 76 hợp chất, QTOF có 33 chất với LOD thấp hơn, QTRAP có 60 chất với LOD thấp hơn (Hình 5). Kết quả cũng chỉ ra trong các chất quan tâm, 76 chất có cùng LOD ở cả 2 phương pháp QTOF và QTRAP, 60 chất LOD của QTRAP tốt hơn, và chỉ có 33 chất LOD của QTOF tốt hơn. Giải thích về LOD của 1 số chất tốt hơn với QTOF có thể là do SRM của phương pháp QTRAP chưa thực sự chọn lọc, trong nền mẫu sinh học phức tạp vẫn xảy ra nhiều cản trở, trong các trường hợp này độ phân giải khối của QTOF giúp tăng độ chọn lọc và loại bỏ được cản trở tốt hơn.
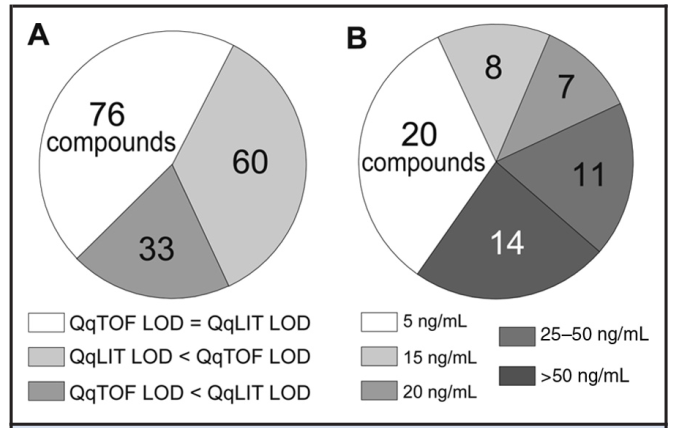
Hình 5. So sánh LOD của các chất quan tâm (A) đo bởi QTOF, (B) đo vởi QTRAP.
3.2. Ảnh hưởng của nền mẫu
Kết quả chỉ ra rằng QTOF chịu ảnh ảnh hưởng từ nền mẫu nhiều hơn với giá trị trung bình về độ lệch chuẩn của ME là -25%. Trong khi ảnh hưởng nền mẫu lên QTRAP có xu hướng thấp hơn với giá trị trung bình độ lệch chuẩn của ME chỉ là 3%. Tuy nhiên trong cả 2 trường hợp, một số hợp chất xuất hiện hiệu ứng tăng cường tín hiệu (ion enhancement) lên tới > 200% ví dụ như: olanzapine, prochlorperazine và diphenoxylate với QTOF.
3.3. So sánh các mẫu bệnh phẩm
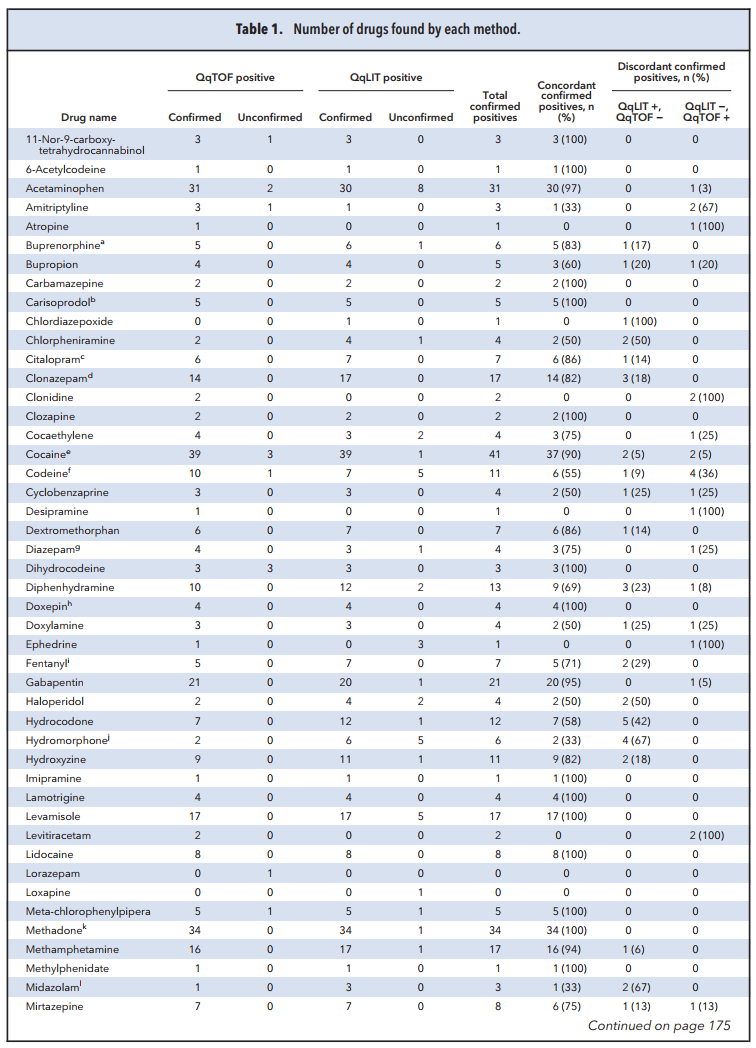
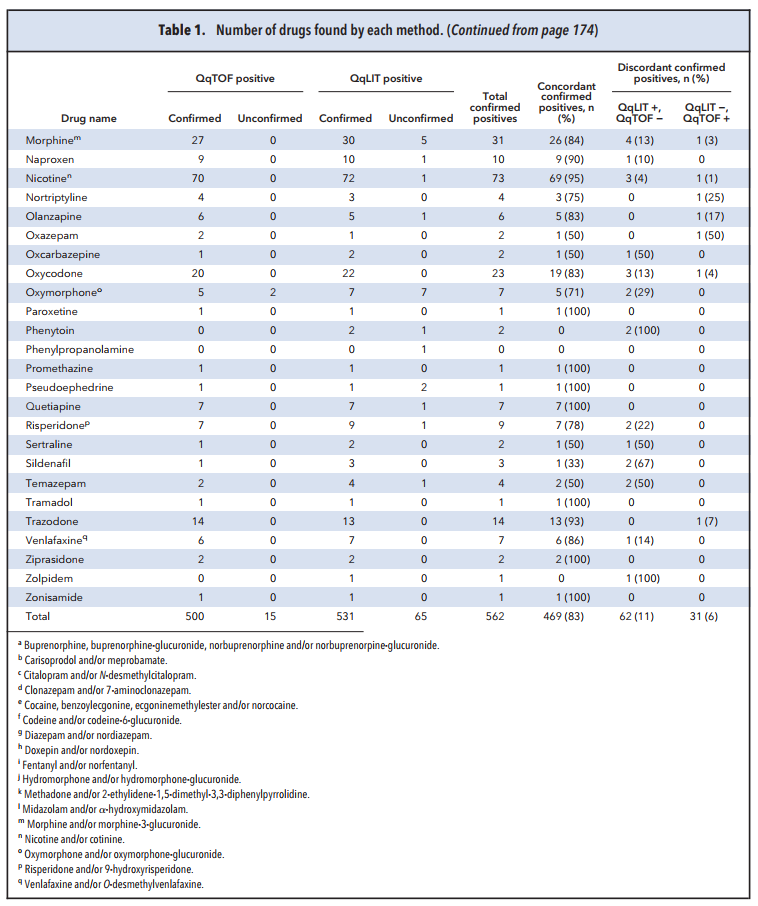
Cho 100 mẫu nước tiểu với 169 chất mục tiêu, QTRAP phát hiện dương tính 596 lần các chất và 89% các trường hợp được tái xác nhận bằng các phương pháp khác. QTOF phát hiện dương tính 515 lần các chất và 97% các trường hợp được tái xác nhận bằng các phương pháp khác. Trong đó, 469 phát hiện dương tính được thực hiện bằng cả 2 phương pháp, 62 chất được xác nhận dương tính chỉ với QTRAP, 31 chất được xác nhận dương tính chỉ với QTOF.
Sự khác biệt giữa khả năng xác nhận dương tính giữa 2 phương pháp có thể được giải thích là do sự khác biệt ở cách ghi tín hiệu quét thăm dò. Với QTOF, việc lựa chọn chất được dựa vào số khối chính xác của ion mẹ. Trong khi với QTRAP, việc lựa chọn chất dựa trên việc theo dõi các chuyển đổi ion mẹ tạo thành ion con (transition). Độ chọn lọc của QTRAP phụ thuộc vào việc chọn lựa cẩn thận các “transition” đặc thù cho chất. Và do đó vẫn có thể tồn tại các “transition” chưa thực sự chọn lọc, từ đó gây ra sự sự khác biệt giữa 2 phương pháp. QTRAP cũng thể hiện độ nhạy tốt hơn so với QTOF do thiết bị chỉ cần ghi tín hiệu theo 1 danh sách các chất đã biết trước. Một số chất chỉ được phát hiện với QTRAP có thể liên quan tới độ nhạy kém hơn của QTOF so với QTRAP. Ví dụ: clonazepam không được xác nhận 1 vài lần do sự khác biệt về LOD của metabolite 7-aminoclonazepam (LOD = 25 ng/mL cho QTRAP vs 100 ng/mL cho QTOF). QTOF không xác nhận được một vài hợp chất do không thể ghi được phổ phân mảnh. Thêm vào đó, mặc dù QTOF có thể thực hiện được nhiều “IDA experiment” theo sau 1 “survery scan”, tuy nhiên nền mẫu phức tạp có thể làm các “IDA experiment” này chủ yếu ghi tín hiệu cho các ion tới từ nền mẫu và bỏ lỡ các hợp chất quan tâm.
Bảng 1. Số lượng các chất tìm được bởi từng phương pháp.
4. Kết luận
Việc sử dụng QTRAP cũng như QTOF để xác nhận các chất cấm trong danh sách có sẵn có hiêu quả gần như tương tự. QTRAP sẽ có lợi thế hơn về độ nhạy, trong khi đó QTOF có lợi thế hơn về khả năng phân tích các chất chưa biết mà không cần tốn nhiều thời gian để thiết lập phương pháp (khối phổ).
5. Tài liệu tham khảo
Dresen, S., Ferreirós, N., Gnann, H., Zimmermann, R., & Weinmann, W. (2010). Detection and identification of 700 drugs by multi-target screening with a 3200 Q TRAP® LC-MS/MS system and library searching. Analytical and Bioanalytical Chemistry, 396(7), 2425–2434. https://doi.org/10.1007/s00216-010-3485-2
Schymanski, E. L., Jeon, J., Gulde, R., Fenner, K., Ruff, M., Singer, H. P., & Hollender, J. (2014). Identifying Small Molecules via High Resolution Mass Spectrometry: Communicating Confidence. Environmental Science & Technology, 48(4), 2097–2098. https://doi.org/10.1021/es5002105
Thoren, K. L., Colby, J. M., Shugarts, S. B., Wu, A. H. B., & Lynch, K. L. (2016). Comparison of information-dependent acquisition on a tandem quadrupole TOF vs a triple quadrupole linear ion trap mass spectrometer for broad-spectrum drug screening. Clinical Chemistry, 62(1), 170–178. https://doi.org/10.1373/clinchem.2015.241315