
Đang tải...

Đang tải...
Tổng quan về phân tích thuốc hạ cholesterol máu trong các mẫu sinh học
Tác giả: Hung Le
Giới thiệu: Bài viết này trình bày tổng quan sơ bộ một số phương pháp xử lý mẫu và phân tích một số thuốc hạ cholesterol máu và trình bày quan điểm của tác giả liên quan tới việc phân tích các chất liên quan. Về tác giả, TS. Lê Sĩ Hưng, tốt nghiệp tiến sĩ tại đại học BOKU Vienna (Cộng hoà Áo) ngành hoá phân tích, đã có trên 10 năm kinh nghiệm làm việc với các thiết bị khối phổ, tập trung vào ứng dụng các kỹ thuật khối phổ trong phân tích các chất chuyển hoá và protein trong các đối tượng mẫu sinh học, ORCID: 0000-0002-0762-3492
1. Giới thiệu
Các thuốc hạ cholesterol máu, hay còn gọi là thuốc hạ lipid máu, đóng vai trò then chốt trong việc kiểm soát tình trạng tăng cholesterol máu và giảm thiểu nguy cơ mắc các bệnh tim mạch. Các thuốc này hoạt động thông qua nhiều cơ chế khác nhau, bao gồm ức chế quá trình tổng hợp cholesterol ở gan (như nhóm statin), giảm hấp thụ cholesterol ở ruột (như ezetimibe), hoặc tăng đào thải cholesterol (như các resin gắn acid mật). Nhóm statin, bao gồm atorvastatin, simvastatin, rosuvastatin, là những thuốc được sử dụng phổ biến nhất, có hiệu quả cao trong việc giảm cholesterol LDL ("cholesterol xấu"). Ezetimibe thường được phối hợp với statin để tăng cường hiệu quả giảm cholesterol, đặc biệt trong trường hợp statin đơn thuần không đủ hiệu quả. Ngoài ra, còn có các thuốc khác như fibrates, PCSK9 inhibitors, và acid béo omega-3, được sử dụng tùy theo tình trạng bệnh và các yếu tố nguy cơ của từng bệnh nhân. Việc lựa chọn và sử dụng thuốc hạ cholesterol cần được cá nhân hóa, dựa trên đánh giá tổng thể của bác sĩ, kết hợp với chế độ ăn uống và lối sống lành mạnh để đạt được hiệu quả điều trị tối ưu. Việc phân tích các thuốc hạ cholesterol đóng vai trò quan trọng trong việc kiểm soát chứng tăng cholesterol máu và giảm nguy cơ bệnh tim mạch. Sắc ký lỏng ghép khối phổ (LC-MS) đã nổi lên như một công cụ mạnh mẽ để phân tích các thuốc này nhờ độ nhạy, độ chọn lọc và tính linh hoạt cao. Kỹ thuật phân tích này cho phép định lượng chính xác các thuốc này và các chất chuyển hóa của chúng trong các nền sinh học phức tạp, chẳng hạn như huyết tương hoặc huyết thanh. Bài tổng quan này cung cấp cái nhìn tổng quan về các khía cạnh khác nhau của phân tích LC-MS các thuốc hạ cholesterol, bao gồm chuẩn bị mẫu, phương pháp phân tích, những phát hiện chính, thách thức và các triển vọng trong tương lai.
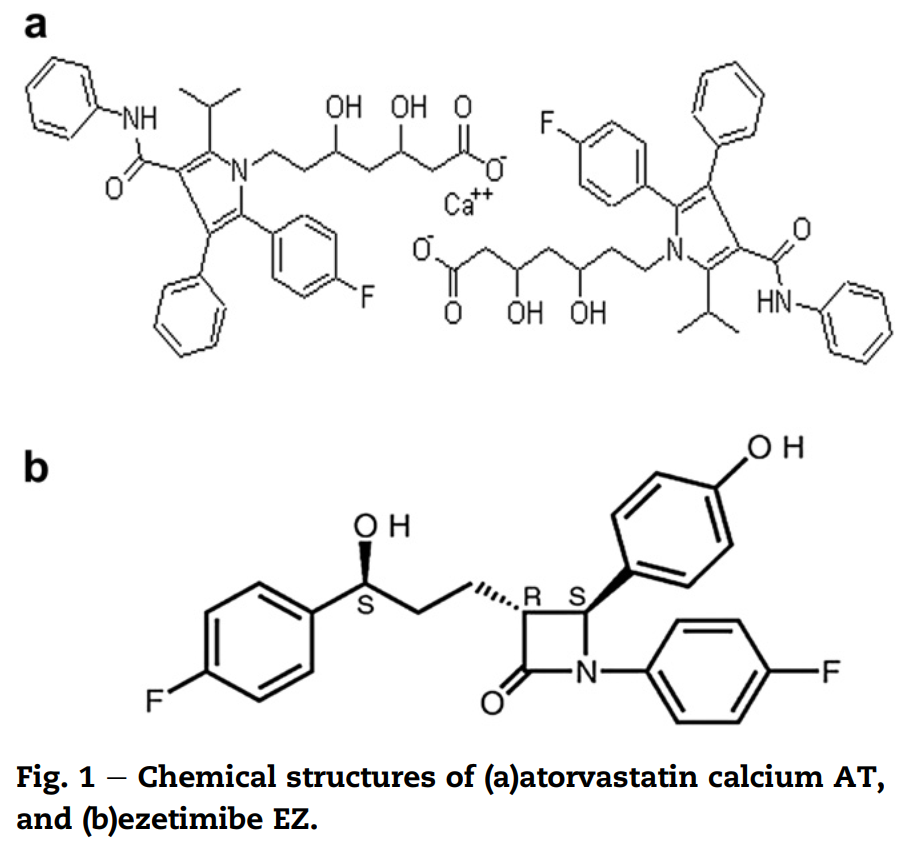
2. Xử lý mẫu
Chuẩn bị mẫu là một bước quan trọng trong phân tích LC-MS, nhằm mục đích tách/làm giàu thuốc mục tiêu khỏi nền sinh học phức tạp và loại bỏ các hợp chất gây nhiễu. Các phương pháp phổ biến để chiết xuất thuốc hạ cholesterol bao gồm LLE và chiết pha rắn (SPE). LLE sử dụng độ hòa tan khác nhau của các chất phân tích trong hai dung môi không trộn lẫn, trong khi SPE hấp phụ chọn lọc các chất phân tích lên pha rắn. Với LLE, methyl tert-butyl ether hoặc ethyl acetate được thêm vào mẫu huyết tương, mẫu sau đó được lắc và ly tâm để hình thành sự tách giữa pha nước và pha hữu cơ. Trong đó các chất phân tích sẽ được phân bố vào pha hữu cơ và được thu thập để tiếp túc các quá trình xử lý mẫu tiếp theo nếu cần. Với SPE, đầu tiên mẫu được đưa lên cột SPE sau khi đã cân bằng/hoạt hoá cột, sau đó cột được rửa bằng các dung môi phù hợp để loại bỏ các các chất cản trở. Cuối cùng chất phân tích được rửa giải khỏi cột và thu lại để làm khô hoặc tái hoà tan trước khi phân tích. Ngoài ra một phương pháp đơn giản hơn là sử dụng kết tủa protein sử dụng dung dịch hữu cơ, tuy đơn giản và chi phí thấp kỹ thuật này có những hạn chế nhất định liên quan tới độ sạch của mẫu được xử lý, đặc biệt là với những mẫu có nền mẫu phức tạp. Thông thường mẫu huyết tương sẽ được thêm acetonitrile hoặc methanol sau đó được lắc và ly tâm để loại bỏ protein kết tủa xuống dưới đáy của lọ đựng. Một lưu ý khác là khi phân tích các dạng metabolite liên hợp trong mẫu nước tiểu, β-glucuronidase có thể được thêm vào để thuỷ phân các dạng liên hợp ezetimibe-glucuronide thành ezetimibe trước khi phân tích.
Việc lựa chọn phương pháp chiết phụ thuộc vào các yếu tố như tính chất hóa học của thuốc, nền mẫu và độ nhạy mong muốn. Bảng 1 tóm tắt một số phương pháp xử lý mẫu được và đối tượng mẫu được báo cáo trong một số nghiên cứu đã công bố.
Bảng 1. Một số kỹ thuật xử lý mẫu được sử dụng để phân tích các thuốc hạ cholesterol trong các đối tượng mẫu sinh học.
|
Thuốc |
Loại mẫu |
Kỹ thuật chiết |
Dung môi/cột chiết |
Chất nội chuẩn |
Nguồn |
|
Atorvastatin, Ezetimibe |
Huyết tương người |
LLE |
Dietyl ete-diclorometan (70:30, v/v) |
Atorvastatin |
[doi:10.5740/jaoacint.11-117] |
|
Atorvastatin, Ezetimibe |
Huyết tương người |
LLE |
Etyl axetat |
Pitavastatin |
[doi:10.1093/chromsci/52.8.773] |
|
Rosuvastatin, Ezetimibe |
Huyết tương người |
LLE |
Metyl tert-butyl ete (MTBE) |
Rosuvastatin-d6 |
[doi: 10.1002/jssc.201800246] |
|
Ezetimibe |
Huyết tương người |
LLE |
Metyl tert-butyl ete |
13C6-Ezetimibe |
[doi:10.1016/j.jpba.2005.07.029] |
|
Ezetimibe, Ezetimibe-G |
Huyết tương người |
SPE |
Cột SPE Oasis HLB, đệm amoni axetat-axit axetic (0,2 M, pH 6,0) |
Ezetimibe-d4 |
[doi:10.1016/j.jchromb.2015.02.012] |
|
Amlodipine, Atorvastatin |
Huyết tương người |
LLE |
Etyl axetat |
Không xác định |
[doi: 10.1080/2331205X.2015.1129790] |
|
Atorvastatin, Ezetimibe |
Huyết tương người |
LLE |
tert-Butyl metyl ete |
Ezetimibe-d4 |
[doi:10.1016/j.scia.2013.01.004] |
|
Simvastatin, Simvastatin-axit |
Huyết tương người |
LLE |
Etyl axetat với đệm amoni format |
Fluvastatin |
[doi:10.1016/j.talanta.2023.100258] |
|
Ezetimibe |
Mẫu tình nguyện |
LLE |
tert-Butyl metyl ete |
- |
[doi:10.1016/j.scia.2013.01.004] |
|
13 Thuốc hạ lipid máu |
Dấu vân tay |
Kết tủa protein |
Methanol (0,5 mL) |
- |
[doi:10.1016/j.jchromb.2021.122496] |
Các quy trình chuẩn bị mẫu để phân tích các thuốc hạ cholesterol trong mẫu sinh học, điển hình là huyết tương, có một số đặc điểm chung. Phần lớn các nghiên cứu sử dụng LLE, trong đó một dung môi hữu cơ được thêm vào mẫu, hỗn hợp được lắc và ly tâm, dẫn đến sự phân bố của chất phân tích vào pha hữu cơ. Thêm vào đó chiết pha rắn (SPE) cũng là một kỹ thuật được sử dụng phổ biến, đặc biệt trong phân tích đồng thời ezetimibe và chất chuyển hóa glucuronide của ezemtibe, mẫu được cho đi qua một cột chiết chứa vật liệu có khả năng giữ chọn lọc chất phân tích. Chất phân tích sau đó được rửa giải khỏi cột bằng một dung môi thích hợp. Việc thêm vào mẫu huyết tương chất nội chuẩn (một hợp chất có cấu trúc tương đồng với chất phân tích nhưng có thể phân biệt được trong quá trình phân tích) trước hoặc sau quá trình xử lý mẫu cũng rất phổ biến tuỳ thuộc vào mục đích của phân tích. Việc thêm nội chuẩn nhằm mục đích hiệu chỉnh các sai số phát sinh trong quá trình chuẩn bị mẫu và phân tích, từ đó đảm bảo độ chính xác của kết quả. Tùy thuộc vào kỹ thuật chiết được lựa chọn, các bước xử lý mẫu có sự khác biệt (Bảng 2). Cuối cùng, pha hữu cơ thu được từ quá trình LLE hoặc dịch rửa giải từ SPE hoặc quy trình kết tủa protein được làm bay hơi đến khô, phần cặn khô sau đó được tái hòa tan trong một thể tích nhỏ dung môi thích hợp cho phân tích.
Bảng 2. Chi tiết các bước xử lý mẫu được sử dụng trong một số quy trình tham khảo
|
Thuốc |
Loại mẫu |
Các bước chuẩn bị mẫu |
Nguồn |
|
Atorvastatin, Ezetimibe |
Huyết tương người |
1. Thêm 25 µL dung dịch làm việc của chất chuẩn nội (IS) vào 250 µL mẫu huyết tương. |
[doi:10.5740/jaoacint.11-117] |
|
Atorvastatin, Ezetimibe |
Huyết tương người |
1. Thêm 6 mL etyl axetat vào 1000 mL các chuẩn huyết tương hoặc mẫu QC đã thêm chất chuẩn. |
[doi:10.1093/chromsci/52.8.773] |
|
Rosuvastatin, Ezetimibe |
Huyết tương người |
1. Rã đông các mẫu huyết tương người đông lạnh và cân bằng về nhiệt độ phòng. |
[doi: 10.1002/jssc.201800246] |
|
Ezetimibe |
Huyết tương người |
1. Rã đông các mẫu huyết tương người đông lạnh ở nhiệt độ môi trường. |
[doi:10.1016/j.jpba.2005.07.029] |
|
Ezetimibe, Ezetimibe-G |
Huyết tương người |
1. Trộn 200 μL huyết tương đã thêm chất chuẩn với 10 μL dung dịch làm việc của chất chuẩn nội (50 ng/mL) với 300 μL dung dịch đệm amoni axetat-axit axetic (0,2 M, pH 6,0) và lắc vortex trong 1 phút. |
[doi:10.1016/j.jchromb.2015.02.012] |
|
Amlodipine, Atorvastatin |
Huyết tương người |
1. Hút 200 µL mẫu huyết tương đã thu vào ống ly tâm 10 mL. |
[doi: 10.1080/2331205X.2015.1129790] |
|
Atorvastatin, Ezetimibe |
Huyết tương người |
1. Thêm 200 µL dung dịch chuẩn nội (100 ng/mL Ezetimibe-d4 trong methanol) vào 500 µL mẫu huyết tương. |
[doi:10.1016/j.scia.2013.01.004] |
|
Simvastatin, Simvastatin-axit |
Huyết tương người |
1. Thêm 50 μL IS (fluvastatin) vào 100 μL mẫu huyết tương. |
[doi:10.1016/j.talanta.2023.100258] |
|
Ezetimibe |
Mẫu tình nguyện |
1. Thêm chất chuẩn nội (IS, 100 ng/mL trong methanol) vào 500 µL mẫu tình nguyện. |
[doi:10.1016/j.scia.2013.01.004] |
|
13 Thuốc hạ lipid máu |
Dấu vân tay |
1. Ấn ngón trỏ vào giấy lọc 3 × 3 cm với lực vừa phải trong 30 giây sau khi đeo găng tay dùng một lần trong 2 phút. |
[doi:10.1016/j.jchromb.2021.122496] |
3. Phân tích các thuốc hạ cholesteron với khối phổ
Mẫu sau khi đã tái hòa tan được bơm vào hệ thống phân tích, thường là LC-MS/MS. Kỹ thuật này cho phép tách chất phân tích và chất chuẩn nội dựa trên các đặc tính hóa học của chúng và xác định hàm lượng tương ứng. LC-MS/MS đã được ứng dụng thành công trong nhiều nghiên cứu dược động học để định lượng nồng độ thuốc tự do và tổng trong huyết tương người sau khi dùng thuốc. Ví dụ, các nghiên cứu đã định lượng atorvastatin và chất chuyển hóa 2-hydroxyatorvastatin trong huyết tương người. Ngoài ra, LC-MS/MS đã được sử dụng để đo ezetimibe và chất chuyển hóa glucuronide của nó trong huyết tương sau khi chuẩn bị mẫu SPE. Các ứng dụng này làm nổi bật tính linh hoạt của LC-MS/MS trong việc nghiên cứu sự hấp thụ, phân bố, chuyển hóa và thải trừ của các thuốc hạ cholesterol.
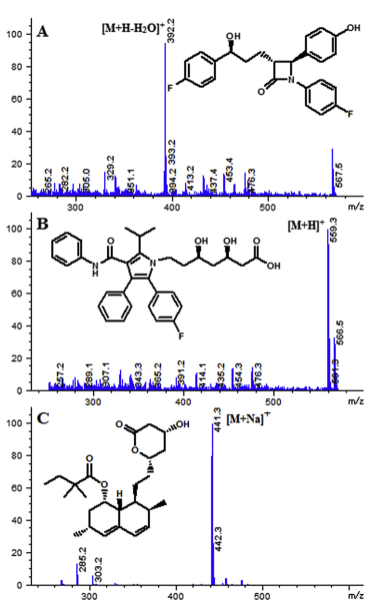
Hình 2. Phổ MS đại diện của ezetimibe (A), Atorvastatin calcium salt trihydrate (B) và simvastatin (C) (Nguồn: 10.1556/1326.2020.00752).
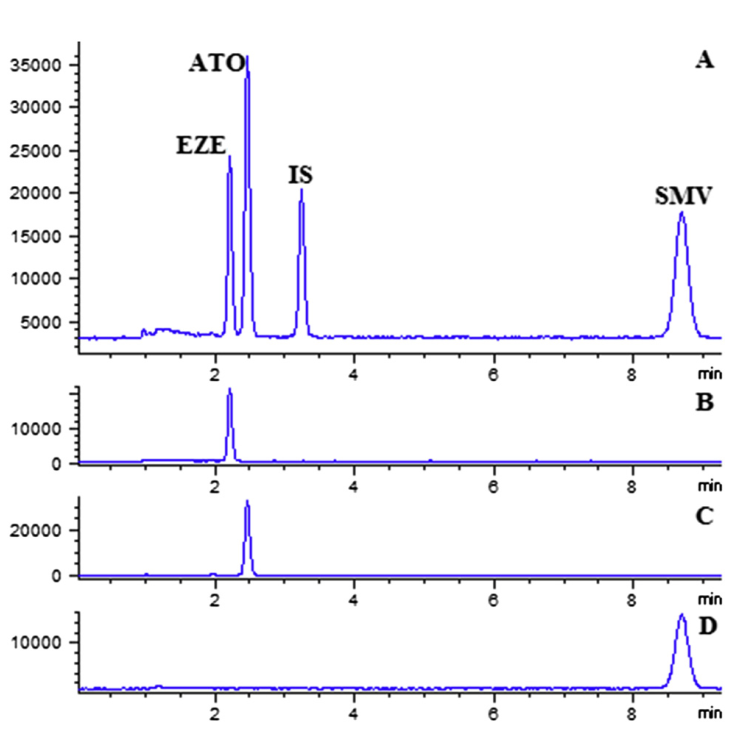
Hình 3. Phổ TIC LC-MS của cả 3 chất phân tích và 1 chất nội chuẩn (A) và phổ EIC của ezetimibe (A), Atorvastatin calcium salt trihydrate (B) và simvastatin (C) (Nguồn: 10.1556/1326.2020.00752)
Nhiều phương pháp LC-MS khác nhau đã được phát triển để phân tích các thuốc hạ cholesterol, trong đó các cột C18 pha đảo (VD: Acquity UPLC® BEH C18, Eclipse-plus C18, Symmetry C18…) được sử dụng phổ biến. Pha động thường bao gồm các dung môi nước và hữu cơ, kèm các chất phụ gia như: axit formic, amoni acetate… để cải thiện hình dạng của píc, tăng cường phân giải píc, cải thiện thời gian lưu và hiệu suất ion hóa. Các kỹ thuật ion hóa thường được sử dụng bao gồm ion hóa phun sương điện tử (ESI) và ion hóa hóa học áp suất khí quyển (APCI). Việc lựa chọn kỹ thuật ion hóa phụ thuộc vào các đặc tính của chất phân tích và độ nhạy mong muốn. Việc phát hiện thường được thực hiện bằng cách sử dụng các chế độ giám sát phản ứng chọn lọc (SRM) hoặc giám sát nhiều phản ứng (MRM) để tăng độ nhạy và độ chọn lọc. Các giới hạn phát hiện (LOD) và giới hạn định lượng (LOQ) được báo cáo cho các thuốc hạ cholesterol khác nhau tùy thuộc vào phương pháp phân tích cụ thể, cách chuẩn bị mẫu và thiết bị được sử dụng (Bảng 3). Ví dụ, LOD cho ezetimibe dao động từ 0,02 ng/mL đối với ezetimibe tự do đến 0,60 µg/mL khi sử dụng điện di mao quản (CZE). Tương tự, LOD cho atorvastatin dao động từ 0,003 ng/miếng dán khi sử dụng sắc ký lỏng hiệu năng siêu cao kết hợp với khối phổ Q-TRAP đến 0,42 µg/mL với CZE.
Bảng 3. Giá trị LOD, LOQ cho 1 số thuốc hạ cholesteron đã được báo cáo
|
Thuốc |
LOD (ng/mL) |
LOQ (ng/mL) |
Nguồn DOI |
Phương pháp phân tích |
|
Ezetimibe |
0,25 |
1,25 |
10.1556/JPC.25.202.399 |
LC-MS/MS |
|
Atorvastatin |
0,25 |
0,75 |
10.1556/JPC.25.202.399 |
LC-MS/MS |
|
Simvastatin |
0,75 |
2.5 |
10.1556/JPC.25.202.399 |
LC-MS/MS |
|
Ezetimibe |
0,48 |
1,46 |
10.1556/JPC.25.202.399 |
LC-MS/MS |
|
Atorvastatin |
0,54 |
1,64 |
10.1556/JPC.25.202.399 |
LC-MS/MS |
|
Simvastatin |
0,27 |
0,82 |
10.1556/JPC.25.202.399 |
LC-MS/MS |
|
Amlodipine |
0,05 |
0,1 |
10.1080/2331205X.2015.1129790 |
LC-MS |
|
Atorvastatin |
0,1 |
0,2 |
10.1080/2331205X.2015.1129790 |
LC-MS |
|
Rosuvastatin |
- |
0,1 |
10.5530/jyp.2017.9.22_0 |
CZE |
|
Ezetimibe |
- |
1,84 |
10.5530/jyp.2017.9.22_0 |
CZE |
|
Atorvastatin |
- |
1,23 |
10.5530/jyp.2017.9.22_0 |
CZE |
|
Ezetimibe |
- |
0,6 |
10.5530/jyp.2017.9.22_0 |
CZE |
4. Kết luận
Mặc dù có nhiều ưu điểm trong việc sử dụng LC-MS để phân tích các thuốc hạ cholesterol trong mẫu sinh học, tuy nhiên vẫn tồn tại những thách thức trong việc phân tích các hợp chất này. Một thách thức là khả năng chuyển đổi tại nguồn các dạng lactone của statin (ví dụ: simvastatin) thành các dạng axit hydroxy hoạt động dẫn đến việc định lượng không chính xác. Một thách thức khác là sự hiện diện của các đồng phân, đối quang, hoặc đồng phân lập thể cho một số loại thuốc, đòi hỏi các phương pháp có khả năng tách và định lượng các đồng phân riêng lẻ.
Việc tiếp tục phát triển và tối ưu hóa các phương pháp LC-MS là rất cần thiết để giải quyết những thách thức này và tiếp tục cải thiện việc phân tích các loại thuốc hạ cholesterol. Các định hướng trong tương lai bao gồm việc khám phá các kỹ thuật chuẩn bị mẫu mới để giảm thiểu ảnh hưởng của nền mẫu và cải thiện độ thu hồi, phát triển các phương pháp LC-MS nhạy và chọn lọc hơn để định lượng các chất chuyển hóa có hàm lượng thấp, và ứng dụng các phương pháp LC-MS để nghiên cứu các tác động chuyển hóa rộng hơn của thuốc hạ cholesterol.
5. Tài liệu tham khảo
Abdelbary, G., & El-Gendy, A. (2013). A validated liquid chromatography-tandem mass spectrometry method for the simultaneous determination of atorvastatin and ezetimibe in human plasma: Application to a bioequivalence study. Journal of Pharmaceutical Research, 10(2), 171-178.
Bhadoriya, D. (2018). Simultaneous estimation of rosuvastatin and ezetimibe in human plasma by LC-MS/MS and its application to a pharmacokinetic study. Journal of Pharmaceutical Analysis, 8(5), 316–321. https://doi.org/10.1016/j.jpha.2018.03.002
Danafar, H., & Hamidi, M. (2013). A rapid and sensitive LC–MS method for determination of ezetimibe concentration in human plasma: Application to a bioequivalence study. Chromatographia, 76, 1667–1675. https://doi.org/10.1007/s10337-013-2548-x
Du, Q., Zhang, Y., Wang, J., & Liu, B. (2021). Simultaneous determination and quantitation of hypolipidemic drugs in fingerprints by UPLC-Q-TRAP/MS. Journal of Chromatography B, 1175, 122496. https://doi.org/10.1016/j.jchromb.2020.122496
Guo, L., Wang, M., He, M., Qiu, F., & Jiang, J. (2015). Simultaneous determination of ezetimibe and its glucuronide metabolite in human plasma by solid phase extraction and liquid chromatography-tandem mass spectrometry. Journal of Chromatography B, 986-987, 87–93. https://doi.org/10.1016/j.jchromb.2015.02.012
Kurbanoglu, S., Esim, O., Ozkan, C. K., Savaser, A., Ozkan, Y., & Ozkan, S. A. (2019). Stability indicating RP-HPLC method for the simultaneous determination of ezetimibe and atorvastatin in their combined dosage form: Method development and validation. Chromatographia, 82(2), 279–285. https://doi.org/10.1007/s10337-018-8440-6
Li, S., Liu, G., Jia, J., Li, X., & Yu, C. (2006). Liquid chromatography–negative ion electrospray tandem mass spectrometry method for the quantification of ezetimibe in human plasma. Journal of Pharmaceutical and Biomedical Analysis, 40(4), 987–992. https://doi.org/10.1016/j.jpba.2005.07.053
Oswal, S., Scheuch, E., Cascorbi, I., & Siegmund, W. (2006). A LC–MS/MS method to quantify the novel cholesterol-lowering drug ezetimibe in human serum, urine and feces in healthy subjects genotyped for SLCO1B1. Journal of Chromatography B, 830(2), 143–150. https://doi.org/10.1016/j.jchromb.2005.10.045
Park, J., Kang, W., Seong, S., Gwon, M., Kim, B., Na, S., Kim, H., Yoon, Y., Lee, H., & Shin, D. (2017). Pharmacokinetic and pharmacodynamic interaction of atorvastatin and ezetimibe in healthy subjects. Translational and Clinical Pharmacology, 25(2), 202–208. https://doi.org/10.1556/JPC.25.202.399
Patel, D., Patel, N., & Desai, P. (2017). A rapid and sensitive stability-indicating reversed-phase high-performance liquid chromatographic method for the determination of related substances of ezetimibe and simvastatin in combined dosage forms. Chromatographia, 80(3), 85–94. https://doi.org/10.1007/s10337-017-3284-x
Varghese, S. J., & Ravi, T. K. (2013). Development and validation of a liquid chromatography/mass spectrometry method for the simultaneous quantitation of rosuvastatin and ezetimibe in human plasma. Journal of AOAC International, 96(2), 307–312. https://doi.org/10.5740/jaoacint.12-261
Wang, L., Chai, Y., Sun, C., Zhu, W., Pan, Y., & Zeng, S. (2017). Direct Differentiation of Stereoisomers of Ezetimibe:Ambrisentan:Atorvastatin and their Mechanism Study by Electrospray Ionization Quadurupole Time-of-Flight Mass. Scientific Reports, 7(1), 1–9. https://doi.org/10.1038/s41598-017-09471-z
Yadav, S., Suresh, K., & Bhadoriya, D. (2015). Method validation of amlodipine and atorvastatin by liquid chromatography mass spectrometry (LC-MS) method in human plasma. Arabian Journal of Chemistry, 13(1), 184–193. https://doi.org/10.1080/2331205X.2015.1129790