
Đang tải...

Đang tải...
Ứng dụng phương pháp chiết pha rắn 96 giếng thể tích rửa giải cực thấp mới để xác định simvastatin và axit simvastatin bằng LC/MS/MS trong huyết tương người
Giới thiệu: Bài viết này tóm tắt và lược dịch nội dung trong nghiên cứu “Application of a novel ultra-low elution volume 96-well solid-phase extraction method to the LC/MS/MS determination of simvastatin and simvastatin acid in human plasma, Amy Y. Yang, Li Sun, Donald G. Musson, Jamie J. Zhao, DOI: 10.1016/j.jpba.2005.01.016”. Thêm vào đó cung cấp cho bạn đọc một số thông tin cơ bản liên quan tới việc phân tích một số thuốc có tác dụng giảm chloesterol trong mẫu sinh học. Về người dịch, TS. Lê Sĩ Hưng, tốt nghiệp tiến sĩ tại đại học BOKU Vienna (Cộng hoà Áo) ngành hoá phân tích, đã có trên 10 năm kinh nghiệm làm việc với các thiết bị khối phổ, tập trung vào ứng dụng các kỹ thuật khối phổ trong phân tích các chất chuyển hoá và protein trong các đối tượng mẫu sinh học, ORCID: 0000-0002-0762-3492
Tóm tắt
Phương pháp chiết mới được sử dụng trong việc xác định simvastatin và axit simvastatin bằng LC/MS/MS trong huyết tương người. Theo phương pháp này, 300 µL mẫu huyết tương được nạp vào đĩa μElution HLB 96 giếng của Waters Oasis, pha tĩnh được rửa bằng 2 × 400 µL MeOH 5% trong nước và các chất phân tích được rửa giải bằng 35 µL ACN/H2O:95/5 hai lần. Các mẫu chiết được pha loãng trong 40 µL amoni metyl acetat (1 mM, pH 4,5). Tách sắc ký được thực hiện trên cột Phenomenex Synergi Max-RP (2,0 mm × 50 mm, 4 µm). Thiết bị Sciex API 3000 giao diện với nguồn turbo ionspray được sử dụng để phân tích các chất. So với các phương pháp chiết pha rắn, chiết lỏng-lỏng và các phương pháp chiết lỏng-lỏng trên chất rắn hỗ trợ đã được phát triển và sử dụng trước đây trong phòng thí nghiệm, phương pháp mới này giảm chi phí nhân công và ít tốn thời gian hơn trong quá trình chuẩn bị mẫu, nhờ loại bỏ bước bay hơi dung môi và hoàn nguyên mẫu sau chiết đã được loại bỏ bằng cách sử dụng đĩa chiết pha rắn μElution này. Phương pháp này đã được chứng minh là nhanh, đáng tin cậy và có thể tái tạo.
Từ khóa: Simvastatin; Axit simvastatin; SPE; đĩa μElution; LC/MS/MS; Huyết tương người
Simvastatin là một tác nhân có hiệu quả cao để điều trị chứng tăng cholesterol máu [1]. Sau khi uống, simvastatin (SV), một lacton không hoạt động, được thủy phân in vivo nhanh chóng thành axit β-hydroxy tương ứng của nó, axit simvastatin (SVA) (Hình 1). Chất sau là một chất ức chế mạnh của HMG-CoA reductase. Các phương pháp LC/MS/MS để định lượng SV và SVA trong huyết tương người đã được báo cáo trước đây bằng cách sử dụng các quy trình chiết khác nhau [2–5], bao gồm chiết pha rắn [2], chiết lỏng-lỏng [3] và chiết lỏng-lỏng trên chất rắn hỗ trợ [4] được sử dụng trong phòng thí nghiệm của chúng tôi và chiết trực tiếp [5] bởi Jemel et al. Phương pháp chiết SPE trực tiếp (online SPE) cho phép làm sạch mẫu đơn giản và tiết kiệm nhân công, tuy nhiên, giới hạn định lượng thấp LLOQ tương đối cao là 0,5 ng.mL-1 và sự chuyển hóa qua lại cao hơn giữa SV và SVA (≤1,0%) không đáp ứng yêu cầu phân tích. Trong số các phương pháp chiết offline, chiết lỏng-lỏng trên chất rắn hỗ trợ trên các cột SPE Chem Elut đã được sử dụng rộng rãi, do độ nhạy tốt (LLOQ là 0,05 ng mL-1), độ tái lặp và hiệu suất chiết cao với hiệu suất chuyển hoá qua lại giữa SV và SVA không đáng kể. Tuy nhiên, phiên bản tự động của chiết lỏng-lỏng trên chất rắn hỗ trợ [6,7] tương đối phức tạp và bước bay hơi dung môi rất tốn thời gian do phải sử dụng 1 lượng lớn dung môi rửa giải trong khi thể tích của các đĩa giếng 96 lại nhỏ và cần phải sử dụng nhiều bước rửa giải và bay hơi. Trong nghiên cứu này, phương pháp phân tích mới sử dụng SPE μElution Oasis HLB để định lượng SV và SVA bằng LC/MS/MS trong huyết tương người được phát triển và thẩm định, phương pháp này không yêu cầu bay hơi dung môi và tái tạo và giảm đáng kể thời gian chuẩn bị mẫu và cải thiện hiệu quả xét nghiệm.
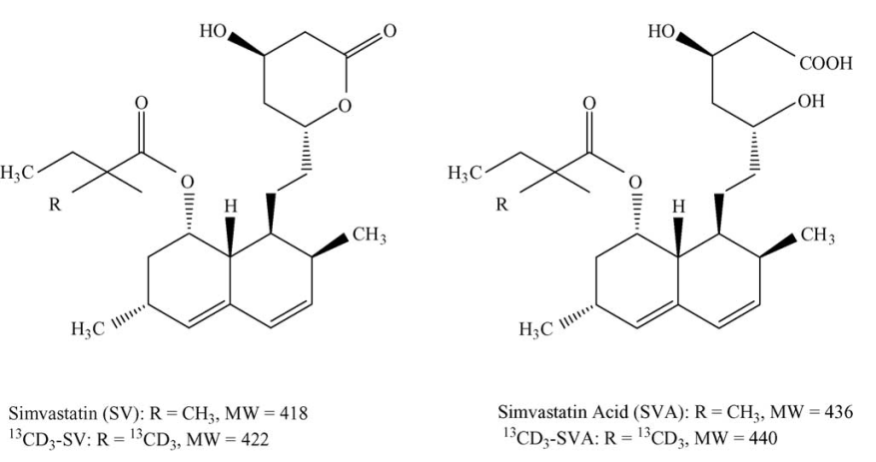
Hình 1. Cấu trúc của các chất phân tích và các chất nội chuẩn.
Các chất chuẩn SV và SVA được tổng hợp bởi Phòng Nghiên cứu Merck. Nội chuẩn đồng vị bền 13CD3-SV và 13CD3-SVA, được tổng hợp bởi Phòng Nghiên cứu Dược phẩm và Trao đổi chất của Merc. Độ tinh khiết đồng vị cho cả hai chất nội chuẩn đều >98,5%.
Các đĩa rửa giải được đóng nhồi chất hấp phụ SPE Oasis HLB. Amoni acetat (cấp HPLC), methylamine (dung dịch 40% trong nước), ACN và MeOH được mua từ Fisher Scientific (Fairlawn, NJ, Hoa Kỳ). Mẫu huyết tương đối chứng gộp của người (đã heparin hóa) được mua từ Biological Specialty (Lansdale, PA, Hoa Kỳ). Nước khử ion được chuẩn bị bằng hệ thống nước Milli-Q Plus Ultra-Pure (Millipore, Bedford, MA, Hoa Kỳ).
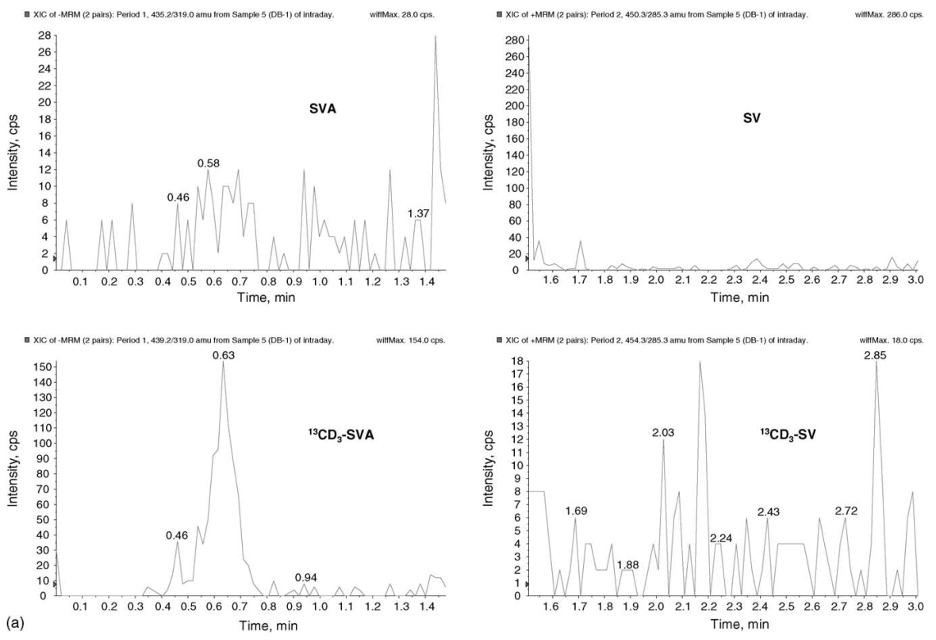
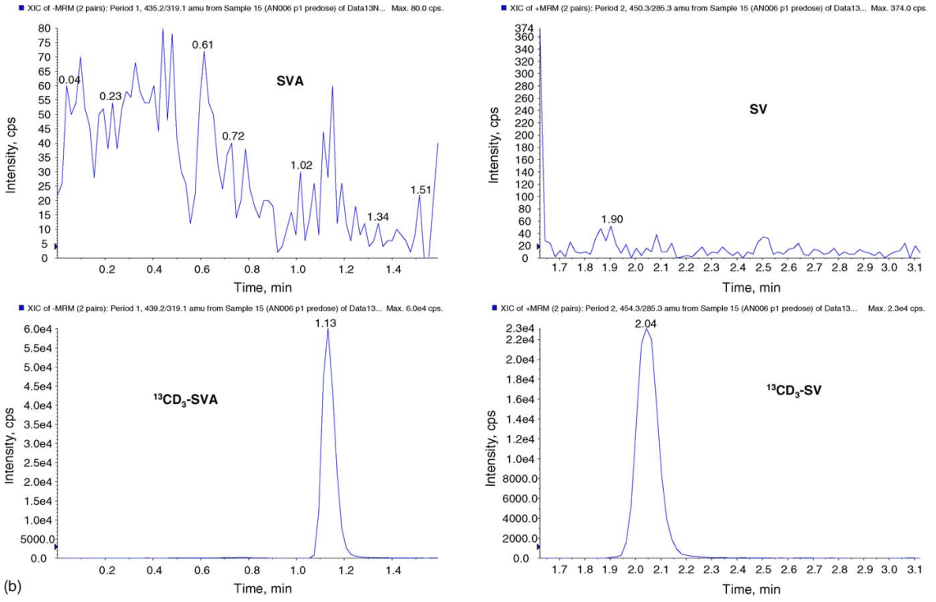
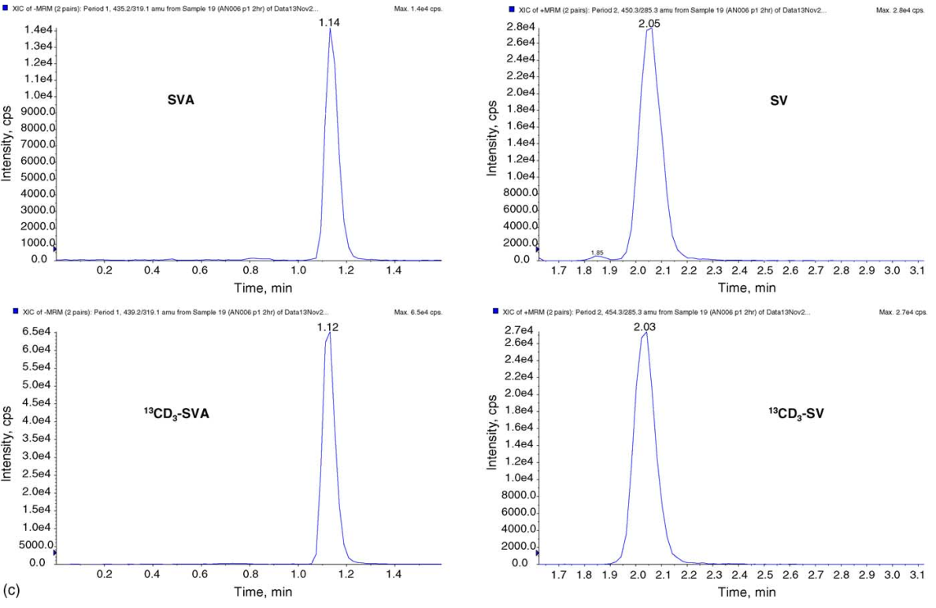
Hình 2. (a) Phổ XIC của mẫu trắng kép trong nền huyết tương người. (b) Phổ XIC của mẫu huyết tương trước khi dùng thuốc của người. (c) XIC của mẫu huyết tương người 2 giờ sau khi dùng 80 mg SV (nồng độ SV và SVA lần lượt là 0,993 và 4,785 ng.mL-1)
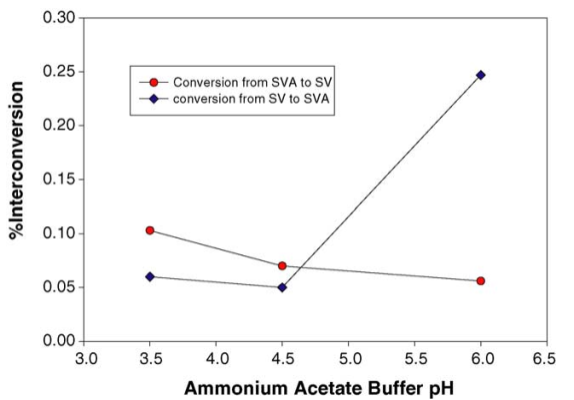
Hình 3: Ảnh hưởng của pH đệm đến sự chuyển đổi lẫn nhau giữa SV và SVA.
Bảng 1. Độ chính xác và độ chụm trong ngày của SV và SVA trong huyết tương người

Bảng 2. Độ chính xác và độ chụm QC giữa các ngày của SV và SVA trong huyết tương người

[1] W.F. Hoffman, A.W. Alberts, P.S. Anderson, R.L. Smith, A.K. Willard, J. Med. Chem. 29 (1998) 849–852.
[2] J.J. Zhao, J.D. Rogers, Proceedings of the 45th ASMS Conferences on Mass Spectrometry and Allied Topics, Palm Springs, CA, June 1–5, 1997, pp. 717.
[3] J.J. Zhao, J.D. Rogers, Proceedings of the 47th ASMS Conferences on Mass Spectrometry and Allied Topics, Dallas, TX, June 13–17, 1999, #TPF199.
[4] J.J. Zhao, I.H. Xie, A.Y. Yang, B.R. Roadcap, J.D. Rogers, J. Mass Spectrom. 35 (2000) 1133–1143.
[5] M. Jemel, Z. Ouyang, M.L. Powell, J. Pharm. Biomed. Anal. 23 (2000) 323–340.
[6] B.A. Roadcap, J.D. Rogers, J.J. Zhao, Proceedings of the 50th ASMS Conferences on Mass Spectrometry and Allied Topics, Orlando, FL, June 2–6, 2002, #MPF187.
[7] L. Liu, R. Valesky, D.G. Musson, J.J. Zhao, Proceedings of the 51th ASMS Conferences on Mass Spectrometry and Allied Topics, Montreal, Que., Canada, June 8–12, 2003, #MPE3 101.
[8] C.R. Mallet, Z. Lu, R. Fish, J.R. Mazzeo, U.D. Neue, Rapid Commun. Mass Spectrom. 17 (2003) 163–170.
[9] N. Zhang, A.Y. Yang, J.D. Rogers, J.J. Zhao, J. Pharm. Biomed. Anal. 34 (2004) 175–187.
[10] J.J. Zhao, A.Y. Yang, J.D. Rogers, J. Mass Spectrom. 37 (2002) 421–433.
[11] R. Fisk, J. Belanger, P. Iraneta, S. Serpa, Z. Lu, C.R. Mallet, J.R. Mazzeo, U.D. Neue, Y. Cheng, LC/GC, The Application Notebook, June 2003, pp. 22–23.