Đang tải...

Đang tải...
Nghiên cứu y sinh về tế bào sống đã được cách mạng hóa vào năm 1934 khi nhà vật lý người Hà Lan - Frits Zernike mô tả khái niệm phản pha. Trong vòng 2 năm, ZEISS đã áp dụng thiết kế ban đầu của Zernike vào kính hiển vi phản pha nguyên mẫu đầu tiên. Kỹ thuật tương phản này đã giúp Zernike đạt giải Nobel Vật lý năm 1953. Cho đến nay, phương pháp này vẫn là phương pháp lý tưởng được nhiều nhà sinh học tế bào lựa chọn cho các mẫu vật mỏng không nhuộm màu như tế bào nuôi cấy trên các bình thủy tinh hoặc nhựa.
Nghiên cứu nuôi cấy tế bào rất quan trọng trong nhiều lĩnh vực nghiên cứu như sinh học tế bào, dược phẩm, công nghệ sinh học đến liệu pháp tế bào và y học tái tạo. Nuôi cấy tế bào còn gọi là nuôi cấy mô, liên quan đến sự phát triển của tế bào trong môi trường nuôi cấy nhân tạo (in vitro). Nó bao gồm việc nuôi cấy các tế bào bám dính, tế bào huyền phù, tế bào sơ cấp, tế bào gốc, vi khuẩn, nấm hoặc tế bào thực vật. Loại thứ hai đôi khi được gọi là nuôi cấy vi sinh vật, nuôi cấy nấm hoặc mô thực vật.
Các sinh vật mẫu và các dòng tế bào bất tử thường được sử dụng để nghiên cứu sinh học của tế bào hoặc mô. Những dòng tế bào như vậy được nuôi cấy trong các bình như đĩa petri, bình hoặc đĩa nhiều giếng. Môi trường nuôi cấy chứa chất dinh dưỡng và các chất bổ sung cung cấp các điều kiện cần thiết cho sự phát triển tối ưu cho tế bào. Tùy thuộc vào loại tế bào, nhiệt độ, độ ẩm và CO2 và O2 nhất định được sử dụng để mô phỏng tốt nhất các điều kiện in vivo. Hầu hết các dòng tế bào động vật có vú được nuôi cấy trong tủ ấm ở nhiệt độ 37°C và 5% CO2.
Phòng thí nghiệm nuôi cấy tế bào sử dụng kính hiển vi hàng ngày để kiểm tra sự phát triển hoặc tăng sinh cũng như sức sống của tế bào. Điều này bao gồm kiểm tra mức độ phủ của tế bào, hình thái của tế bào có bình thường hay không, có bị nhiễm không và khi nào cần thay môi trường nuôi cấy. Những nhiệm vụ này thường yêu cầu kính hiển vi phản pha ở độ phóng đại 50x-200x. Bạn sẽ phải cần nhanh chóng giảm thiểu thời gian ở bên ngoài tủ ấm. Do đó, kính hiển vi nuôi cấy tế bào phải nhỏ gọn để đặt trong tủ nuôi cấy sinh học hoặc sử dụng giúp rút ngắn thời gian xử lý và giảm thiểu sự căng thẳng cho tế bào. Khi các tế bào đạt đến mức độ bao phủ nhất định chúng cần được chuyển sang bình nuôi cấy khác. Trước khi chuyển chúng sang bình nuôi cấy mới, sử dụng máy đếm tế bào hoặc buồng Makler để xác định số lượng tế bào, tính toán hệ số pha loãng thích hợp. Thực hành nuôi cấy tế bào tốt là điều cần thiết vì điều này cung cấp cơ sở cho các kết quả có ý nghĩa và có thể lặp lại trong nghiên cứu của bạn.
Nhiều quy trình kính hiển vi khác được thực hiện trong phòng thí nghiệm nuôi cấy tế bào. Các xét nghiệm điển hình bao gồm xét nghiệm chữa lành vết xước hoặc vết thương, xét nghiệm khả năng sống chết và xét nghiệm Transwell. Ngoài việc quan sát phản pha và trường sáng, huỳnh quang thường được sử dụng và đang trở thành một tiêu chuẩn. Protein trong tế bào hoặc mô có thể được dán nhãn bằng chất đánh dấu miễn dịch huỳnh quang. Nhiều loại miễn dịch huỳnh quang khác nhau trong đó có DAPI, Hoechost, GFP, Alexa 488, Texas Red và Cy3 cho phép bạn phân biệt và định vị các tín hiệu huỳnh quang bằng hiển vi huỳnh quang đa kênh.
Mặt khác, các tế bào sống có thể được chuyển các ADN hoặc ARN ngoại lai để biểu hiện ví dụ các protein huỳnh quang. Mức độ biểu hiện và hiệu quả truyền là các chỉ số chính trong quy trình này. Có thể thu được hình ảnh huỳnh quang bằng cách sử dụng điôt phát sáng (LEDs). Phản ứng độc với ánh sáng (phototoxic) bắt nguồn từ tia cực tím (UV) không mong muốn sẽ giảm đi so với các nguồn chiếu sáng huỳnh quang khác như đèn hồ quang thủy ngân. Ngoài ra, đèn LED còn có tuổi thọ tăng đáng kể và không cần bảo trì.
Ví dụ các ứng dụng:
Nghiên cứu y sinh về tế bào sống đã được cách mạng hóa vào năm 1934 khi nhà vật lý người Hà Lan - Frits Zernike mô tả khái niệm phản pha. Trong vòng 2 năm, ZEISS đã áp dụng thiết kế ban đầu của Zernike vào kính hiển vi phản pha nguyên mẫu đầu tiên. Kỹ thuật tương phản này đã giúp Zernike đạt giải Nobel Vật lý năm 1953. Cho đến nay, phương pháp này vẫn là phương pháp lý tưởng được nhiều nhà sinh học tế bào lựa chọn cho các mẫu vật mỏng không nhuộm màu như tế bào nuôi cấy trên các bình thủy tinh hoặc nhựa.
Nghiên cứu nuôi cấy tế bào rất quan trọng trong nhiều lĩnh vực nghiên cứu như sinh học tế bào, dược phẩm, công nghệ sinh học đến liệu pháp tế bào và y học tái tạo. Nuôi cấy tế bào còn gọi là nuôi cấy mô, liên quan đến sự phát triển của tế bào trong môi trường nuôi cấy nhân tạo (in vitro). Nó bao gồm việc nuôi cấy các tế bào bám dính, tế bào huyền phù, tế bào sơ cấp, tế bào gốc, vi khuẩn, nấm hoặc tế bào thực vật. Loại thứ hai đôi khi được gọi là nuôi cấy vi sinh vật, nuôi cấy nấm hoặc mô thực vật.
Các sinh vật mẫu và các dòng tế bào bất tử thường được sử dụng để nghiên cứu sinh học của tế bào hoặc mô. Những dòng tế bào như vậy được nuôi cấy trong các bình như đĩa petri, bình hoặc đĩa nhiều giếng. Môi trường nuôi cấy chứa chất dinh dưỡng và các chất bổ sung cung cấp các điều kiện cần thiết cho sự phát triển tối ưu cho tế bào. Tùy thuộc vào loại tế bào, nhiệt độ, độ ẩm và CO2 và O2 nhất định được sử dụng để mô phỏng tốt nhất các điều kiện in vivo. Hầu hết các dòng tế bào động vật có vú được nuôi cấy trong tủ ấm ở nhiệt độ 37°C và 5% CO2.
Phòng thí nghiệm nuôi cấy tế bào sử dụng kính hiển vi hàng ngày để kiểm tra sự phát triển hoặc tăng sinh cũng như sức sống của tế bào. Điều này bao gồm kiểm tra mức độ phủ của tế bào, hình thái của tế bào có bình thường hay không, có bị nhiễm không và khi nào cần thay môi trường nuôi cấy. Những nhiệm vụ này thường yêu cầu kính hiển vi phản pha ở độ phóng đại 50x-200x. Bạn sẽ phải cần nhanh chóng giảm thiểu thời gian ở bên ngoài tủ ấm. Do đó, kính hiển vi nuôi cấy tế bào phải nhỏ gọn để đặt trong tủ nuôi cấy sinh học hoặc sử dụng giúp rút ngắn thời gian xử lý và giảm thiểu sự căng thẳng cho tế bào. Khi các tế bào đạt đến mức độ bao phủ nhất định chúng cần được chuyển sang bình nuôi cấy khác. Trước khi chuyển chúng sang bình nuôi cấy mới, sử dụng máy đếm tế bào hoặc buồng Makler để xác định số lượng tế bào, tính toán hệ số pha loãng thích hợp. Thực hành nuôi cấy tế bào tốt là điều cần thiết vì điều này cung cấp cơ sở cho các kết quả có ý nghĩa và có thể lặp lại trong nghiên cứu của bạn.
Nhiều quy trình kính hiển vi khác được thực hiện trong phòng thí nghiệm nuôi cấy tế bào. Các xét nghiệm điển hình bao gồm xét nghiệm chữa lành vết xước hoặc vết thương, xét nghiệm khả năng sống chết và xét nghiệm Transwell. Ngoài việc quan sát phản pha và trường sáng, huỳnh quang thường được sử dụng và đang trở thành một tiêu chuẩn. Protein trong tế bào hoặc mô có thể được dán nhãn bằng chất đánh dấu miễn dịch huỳnh quang. Nhiều loại miễn dịch huỳnh quang khác nhau trong đó có DAPI, Hoechost, GFP, Alexa 488, Texas Red và Cy3 cho phép bạn phân biệt và định vị các tín hiệu huỳnh quang bằng hiển vi huỳnh quang đa kênh.
Mặt khác, các tế bào sống có thể được chuyển các ADN hoặc ARN ngoại lai để biểu hiện ví dụ các protein huỳnh quang. Mức độ biểu hiện và hiệu quả truyền là các chỉ số chính trong quy trình này. Có thể thu được hình ảnh huỳnh quang bằng cách sử dụng điôt phát sáng (LEDs). Phản ứng độc với ánh sáng (phototoxic) bắt nguồn từ tia cực tím (UV) không mong muốn sẽ giảm đi so với các nguồn chiếu sáng huỳnh quang khác như đèn hồ quang thủy ngân. Ngoài ra, đèn LED còn có tuổi thọ tăng đáng kể và không cần bảo trì.
Ví dụ các ứng dụng:
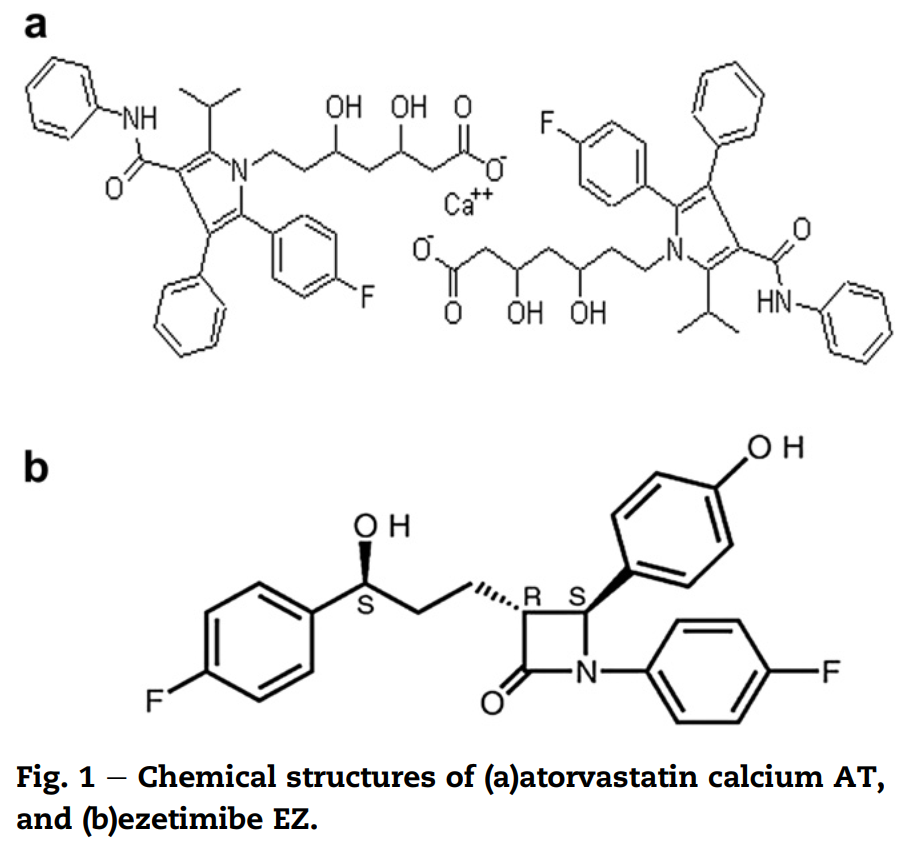
Hình 1: Tế bào MDCK (chó) sau thời gian ủ ngắn thu được bằng Axio Observer
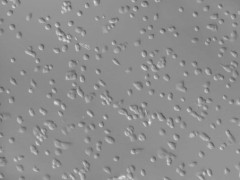
Hình 2: Protoplast thuốc lá quan sát dưới kĩ thuật trường sáng
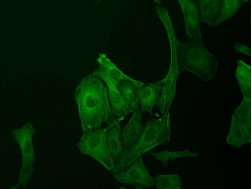
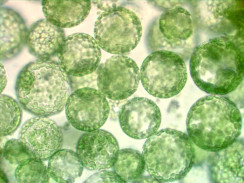
Hình 3: Tế bào U2OS được chụp trong nuôi cấy tế bào, nhuộm GFP actin
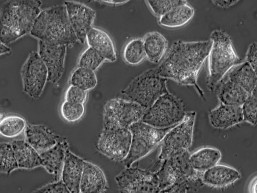
Hình 4: Tế bào Hela chụp bởi Primovert sử dụng kĩ thuật phản pha